« PH du sol » : différence entre les versions
m (suppression parenthèses) |
|||
| Ligne 58 : | Ligne 58 : | ||
==Explication du pH du sol== | ==Explication du pH du sol== | ||
De la définition des acides et des bases de | De la définition des acides et des bases de Brønsted et Lowry (1923), il se déduit que le pH d’une suspension sol/eau est le résultat d’un équilibre entre les sites acides, sources de H<sup>+</sup>, et les sites basiques, puits de H<sup>+</sup>. Pour expliquer le pH du sol, Bruckert et Rouiller (1994 : 511), commentant l’équilibre ci-dessous, écrivent que « les ions H<sub>3</sub>O<sup>+</sup> en solution sont en relation avec des protons non dissociés, fixés à la matrice organo-minérale du sol » (symbolisés dans l’équilibre par « HA (sol) ») : | ||
<center>HA (sol) + H2O ↔ A- (sol) + H<sub>3</sub>O<sup>+</sup></center> | <center>HA (sol) + H2O ↔ A- (sol) + H<sub>3</sub>O<sup>+</sup></center> | ||
Cette réaction d'équilibre peut se dérouler dans les deux sens, exprimant que les « H<sub>3</sub>O<sup>+</sup> » de la solution du sol sont en équilibre avec les protons non dissociés, les « HA (sol) », qui sont les sites acides du sol, c’est-à-dire donnant des ions H<sup>+</sup> d’une part et, d’autre part, avec les « A<sup>-</sup> (sol) » qui sont les sites basiques du sol, c’est à dire acceptant des ions H<sup>+</sup>. Ces sites sont dits « à charge variable » car un même site est à l’état soit acide, soit basique (l’acide et la base conjuguée). Ils sont situés à la surface de l’argile et de la MO (voir capacité d’échange). Ainsi, '''pour des pH de 5 à 7,5, le pH du sol est contrôlé par les sites à charges variables''' (Charlet, 2001). Le nombre total de ces sites est constant dans le temps pour un sol donné, sauf si la teneur en matière organique évolue, et ce nombre est beaucoup plus grand que celui des H+ de la solution du sol. | Cette réaction d'équilibre peut se dérouler dans les deux sens, exprimant que les « H<sub>3</sub>O<sup>+</sup> » de la solution du sol sont en équilibre avec les protons non dissociés, les « HA (sol) », qui sont les sites acides du sol, c’est-à-dire donnant des ions H<sup>+</sup> d’une part et, d’autre part, avec les « A<sup>-</sup> (sol) » qui sont les sites basiques du sol, c’est à dire acceptant des ions H<sup>+</sup>. Ces sites sont dits « à charge variable » car un même site est à l’état soit acide, soit basique (l’acide et la base conjuguée). Ils sont situés à la surface de l’argile et de la MO (voir capacité d’échange). Ainsi, '''pour des pH de 5 à 7,5, le pH du sol est contrôlé par les sites à charges variables''' (Charlet, 2001). Le nombre total de ces sites est constant dans le temps pour un sol donné, sauf si la teneur en matière organique évolue, et ce nombre est beaucoup plus grand que celui des H+ de la solution du sol. | ||
==Relations entre le pH du sol et les pouvoirs tampons du sol== | ==Relations entre le pH du sol et les pouvoirs tampons du sol== | ||
Version du 27 juin 2022 à 10:58
Auteurs : Jean-Luc Julien, Guilhem Bourrié, Ary Bruand, Christian Feller, Pierre Morlon, Daniel Tessier et Folkert van Oort
| Le point de vue de... | |
|---|---|
Pas de compléments pour cet article
| |
| Annexes de l'article | |
Pas d'annexes pour cet article
| |
| Voir aussi (articles complémentaires) | |
| Autres langues | |
| Informations complémentaires | |
Article accepté le 15 juin 2022
| |
| Article mis en ligne le 15 juin 2022 |
Définition
Le pH est une grandeur caractéristique de solutions, telles que les solutions aqueuses, susceptibles de donner des protons H+. Il est une mesure de la concentration « efficace » des ions H+, leur « activité ». Le pH d’un solide n’existe donc pas. L’expression « pH du sol » est un raccourci de langage pour désigner la réaction du sol avec l’eau. Le pH du sol se mesure sur un échantillon séché et broyé (terre fine < 2mm ; ISO 10390, 2005) dont le rapport volumique sol/eau est de 1/5 en France. Dans les pays anglo-saxons, une solution diluée de CaCl2 est utilisée pour se rapprocher des conditions in situ ; la valeur du pH obtenue y est plus basse qu’avec l’eau.
Le pH du sol est très utilisé par les agronomes pour caractériser un sol, avec la texture, la teneur en matière organique (MO), la capacité d’échange cationique (CEC) et les cations échangeables du sol. C’est une mesure simple, peu coûteuse, qui correspond à une notion chimique, l’acidité, facile à appréhender au premier abord. À la demande des agriculteurs, 250 000 analyses de terre sont réalisées chaque année en France (Lambert, 2018). Selon les statistiques de la Base de Données des Analyses de Terre (BDAT), le pH est déterminé pour 95% d’entre elles (Saby et al., 2014).
Histoire des connaissances sur l’acidité et le pH du sol
Les connaissances et les représentations qu’ont les agronomes de l’acidité du sol et leur compréhension des processus qui y sont associés ont profondément évolué en 300 ans. Le pH du sol, les cations échangeables et la capacité d’échange illustrent cette évolution et sont historiquement liés : il est utile de lire ces trois articles, si possible dans cet ordre. Leur histoire est abordée ici du point de vue des agronomes français. Les relations avec la nutrition des plantes et le cas du pH des sols salés ne sont pas traités.
Les chimistes, l’acidité et le pH
La notion d’acide, contrairement à celle de base, est connue de tous : nous savons reconnaître si un aliment a une saveur acide. Le mot vient du latin acidus, aigre, et le premier acide connu est le vinaigre. Jusqu’au XVIIIe siècle, son opposé est le terme alkali, de l’arabe al-kali, cendre de plantes. Au VIIIe siècle, Geber (Abu Musa Jâbir Ibn Hayyan Al-Sufi, 721-815), le plus célèbre alchimiste arabe, fut l’un des premiers à préparer et utiliser « l’huile de vitriol »[1] (l’acide sulfurique, mais impur), « l’eau forte » (l’acide nitrique) et « l’eau régale » (75% d’acide chlorhydrique et 25% d’acide nitrique) dénommée ainsi car elle avait pour propriété de dissoudre le roi des métaux, l’or. Il savait aussi préparer l’alkali végétal caustique (KOH) à partir des cendres, et la chaux par calcination du calcaire (Ouertatani & Dumon, 2007).
Au XVIIe siècle, pour les chimistes, les acides sont pourvus de petites aiguilles très fines ; les alkalis, au contraire, sont des particules poreuses en forme de gaine ; et la réaction entre un acide et un alkali est vue comme un combat dans lequel l’acide perd ses pointes (Saint André, 1672, cité par Metzger, [1922] 1969). Les indicateurs colorés, étudiés systématiquement par Boyle (1661 et 1675 cités par Ouertatani & Dumon, 2007), sont utilisés pour savoir si une solution est acide ou alcali.
Au XVIIIe siècle, Rouelle (1744 et 1754) introduit le concept de base : un sel se compose d’un acide et « d’une substance qui lui sert de base » (Franckowiak, 2002 : 2). Les chimistes classent les acides et les bases selon leur affinité (Geoffroy, 1718 ; Bergman, 1783). Les recherches portent sur l’élément à l’origine de l’acidité. Lavoisier (1778) pense que c’est l’oxygène, le « principe oxygine », que l’on peut résumer ainsi : un acide = radical + oxygène, une base = métal + oxygène et un sel = base + acide.
Berthollet remet en question ce principe dès 1803 ; puis de nombreuses hypothèses sont formulées (Thénard & Gay-Lussac, 1809a et b ; Davy, 1815 ; Dulong, 1815). Liebig propose que « la faculté d’une base de neutraliser un acide (…) dépend de son contenu en oxygène » (1837 : 174) et que « la capacité de saturation d’un acide dépend de la quantité d’hydrogène qu’il contient » (1838 : 81 ; Ouertatani & Dumon, 2007).
Plus tard, l’acidité est expliquée par la théorie de la dissociation électrolytique d’Arrhenius (1887) : « un acide donne un ion H+, une base donne un ion OH- ». Cette théorie fut l’une des plus controversées de l’histoire de la chimie, car aucune connaissance de la structure de l’atome ne pouvait alors l’étayer (Bardez, 2010). Sørensen (1909) utilise la mesure de la concentration en H+ d’une solution au moyen d’une électrode à hydrogène et une autre au calomel servant de référence. Il adopte une notation logarithmique PH. Clark (1920) propose la notation « pH ». La concentration en H+ s’exprime donc ainsi : [H+] = C = 10-pH ; pour un pH de 7, la concentration est de 10-7 mol/L ; pour un pH de 4, soit une concentration de 10-4 mol/L, la concentration en H+ est donc mille fois plus élevée que pour un pH de 7.
En 1923, les acides et les bases sont définis de deux façons qui ne se recoupent pas tout à fait : celles, identiques, de Brønsted et de Lowry et celle, différente, de Lewis ; en effet, certains acides, ou bases, de Lewis ne le sont pas au sens de Brønsted et Lowry. Celle de Brønsted et Lowry est bien adaptée à la compréhension du pH du sol : « un acide donne un ion H+, une base l’accepte ». Sørensen et Linderstrøm-Lang (1924) établissent que le pH est une mesure, non de la concentration, mais de l’activité de H+ : l’activité ionique rend compte des phénomènes d'interactions entre ions en solution (Lewis, 1907, définition p 262), ces interactions augmentant lorsque la concentration augmente. Le pH-mètre est inventé en 1935.
Les agronomes, l’acidité et le pH des sols
Très tôt, les agronomes ont noté que la chaux vive permet d’améliorer les terres. Olivier de Serres écrit : « pour l'amendement des terres (…) la chaux neuve est de grande efficace (…), laquelle mêlée avec quelques terriers, balieures [balayures], ou autres fumiers, et jetée au champ au commencement de l'hiver, l'engraisse très bien » ([1600] 1804 : 127). Plus tard, sous le titre « Manière de cultiver les Terres en basse Normandie du côté de Bayeux, où l’on est dans l’usage de les fumer avec de la chaux vive », Duhamel du Monceau décrit « la façon d’améliorer les terres au moyen de la chaux vive » (1754 : 44-45).
Au début du XVIIIe siècle, Liger nomme des terres « aigres » : « elle (la terre) est aigre, revêche ou maigre quand elle abonde en productions amères, froides et épineuses, comme fougères, bruyères, absinthe, genièvre, genêt » (1721 : 484). A la fin du siècle, Rozier, après avoir décrit comment extraire les sels du sol, précise : « s’il est acide, si on le fait dissoudre dans une portion d’eau, et si on verse cette eau sur du sirop de violette (…), la couleur violette de cette eau sirupeuse deviendra rouge. Si le sel est alcali, la couleur violette verdira. Mais si le sel est neutre, la couleur restera intacte » (1796 : 400).
Au XIXe siècle, Thaër, le père de la théorie de l’humus, identifie le caractère acide de l’humus et de certains sols : « on découvre l’acidité de l’humus en plongeant une bande de papier teint en bleu avec du tournesol, dans une pâte liquide faite avec la terre (...) Si ce papier devient rouge, c’est signe qu’il y a de l’acide » ([1810] 1812 : 121-122). Il décrit des « prairies aigres et acides » ([1812] 1814 : 233-234). Gasparin parle des « terreaux acides » et écrit : « l’eau dans laquelle les terres ont été mises en digestion, ou dans laquelle elles ont bouilli, rougit le papier de tournesol » (1843 : 317).
Surtout, Gasparin relie le chaulage à l’acidité du sol : « on ne peut nier le bon effet de la chaux sur les terrains qui recèlent un principe acide » (1843 : 76). Boussingault est plus précis : « La chaux est aussi nécessaire aux plantes que les autres alcalis ; de plus, elle neutralise les acides développés dans certains sols » (1864 : 170). Les agronomes considèrent comme Garola que « le calcaire est l'agent indispensable à la manifestation des principales propriétés chimiques des sols : pouvoir absorbant, nitrification, humification des matières organiques, etc. ; le calcaire diminue notablement la plasticité des terres argileuses et leur ténacité. En facilitant l’écoulement des eaux, il accroît le réchauffement du sol et la faculté d'évaporation » (1903 : 31). Hall écrit en 1906 (p 381) que « la chaux est nécessaire en tant que base et non en tant que composé du calcium » : il restera l’un des rares agronomes du XXe siècle à avoir réellement compris l’apport d’Arrhenius (1887).
Les expressions sols acides (Garola, 1903) et sols alcalins apparaissent vers 1900 (Demolon, 1932 : 198), puis la mesure du pH se généralise. Demolon explique « qu’une augmentation de la concentration en ions H correspond donc à une diminution de pH et inversement » (1932 : 181-183). La caractérisation par les agronomes du sol comme acide ou alcalin devient alors très courante. Mais Ruellan et Deletang (1967) remarquent avec justesse que l’acidité d’un sol apparaît comme « une donnée qui est encore bien mal définie » (Ruellan & Delétang, 1967 : 47).
L’acidité et le pH d’un sol resteront mal définis jusqu’à la fin du XXe siècle. Pour les agronomes comme pour les pédologues, deux raisons concourent à cette mauvaise compréhension : les cations Ca2+, Mg2+, K+ et Na+ sont pris pour des « bases » (voir cations échangeables du sol), et la capacité d’échange cationique est considérée comme constante. Pour les étudiants en Science du sol, dans l’ouvrage de référence (Bonneau & Souchier, 1994), l’expression « cations basiques » est encore utilisée et l’explication du pH du sol est peu claire (Bruckert & Rouiller, 1994 : 514 ; Espiau, 1994 : 500).
Le pH du sol en agronomie aujourd’hui
Observée dans les sols très acides, la toxicité aluminique est découverte dans l’entre-deux guerres (Ségalen, 1973 : 88). Juste (1966) est le premier à l’étudier en France dans les sols des Landes. Des agronomes de terrain montrent que le chaulage en limons battants hydromorphes permet de limiter l’apparition des croûtes de battance et la prise en masse, et d’améliorer la vitesse d’infiltration de l’eau (Kockmann & Fabre, 1989 ; Fabre & Kockmann, 2002). Le pH souhaité est de l’ordre de 7. Par ailleurs, de nombreuses études montrent que le pH du sol est un indicateur pertinent de carence ou de toxicité pour de nombreux oligo-éléments (Loué, 1987).
Le pH du sol est le critère de décision d’un chaulage pour deux types de problèmes : l’amélioration de propriétés physiques de certains sols et le risque de toxicité aluminique. Une tendance assez générale, en France mais aussi ailleurs, est de ne chauler que pour éviter la toxicité aluminique (McBride, 1994 : 183). Ainsi, pour les agronomes d’Arvalis, « les enjeux les plus importants du chaulage sont liés à la maîtrise de la toxicité aluminique » (Bouthier & Castillon, 2001). À l’inverse, ceux de l’Institut technique de la betterave (ITB) préconisent des pH proches de la neutralité pour préserver les propriétés physiques du sol (ITB, 2017 et 2020).
Tout récemment est apparue une raison environnementale qui pourrait favoriser un regain d’intérêt pour le pH du sol : il est établi que les émissions de N2O sont fortement réduites pour des pH supérieurs à 6,8 (Hénault et al., 2019).
Explication du pH du sol
De la définition des acides et des bases de Brønsted et Lowry (1923), il se déduit que le pH d’une suspension sol/eau est le résultat d’un équilibre entre les sites acides, sources de H+, et les sites basiques, puits de H+. Pour expliquer le pH du sol, Bruckert et Rouiller (1994 : 511), commentant l’équilibre ci-dessous, écrivent que « les ions H3O+ en solution sont en relation avec des protons non dissociés, fixés à la matrice organo-minérale du sol » (symbolisés dans l’équilibre par « HA (sol) ») :
Cette réaction d'équilibre peut se dérouler dans les deux sens, exprimant que les « H3O+ » de la solution du sol sont en équilibre avec les protons non dissociés, les « HA (sol) », qui sont les sites acides du sol, c’est-à-dire donnant des ions H+ d’une part et, d’autre part, avec les « A- (sol) » qui sont les sites basiques du sol, c’est à dire acceptant des ions H+. Ces sites sont dits « à charge variable » car un même site est à l’état soit acide, soit basique (l’acide et la base conjuguée). Ils sont situés à la surface de l’argile et de la MO (voir capacité d’échange). Ainsi, pour des pH de 5 à 7,5, le pH du sol est contrôlé par les sites à charges variables (Charlet, 2001). Le nombre total de ces sites est constant dans le temps pour un sol donné, sauf si la teneur en matière organique évolue, et ce nombre est beaucoup plus grand que celui des H+ de la solution du sol.
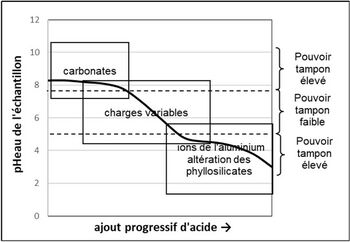
Relations entre le pH du sol et les pouvoirs tampons du sol
Lors d’une titration par un acide, la variation du pH du sol dépend du pH avant l’apport (figure 1) : le pH est plus ou moins « tamponné ». Le « pouvoir tampon » est fort quand la pente de la courbe de la figure 1 est faible. Trois grands types de pouvoirs tampons sont identifiables, liés à certains constituants du sol :
- a) pH > 7,5 : dans les sols calcaires, le pouvoir tampon est fort. Lors de l’acidification, les H+ produits attaquent les liaisons ioniques entre les ions calcium et les ions carbonates, lesquels se protonent en ions hydrogénocarbonates. Si le calcaire est en quantité suffisante, le pH du sol se maintient vers une valeur de 8,2.
- b) 5 < pH < 7,5 : le pouvoir tampon est faible à moyen. Lors de l’acidification, les H+ produits protonent des sites négatifs basiques. Le pouvoir tampon est d’autant plus élevé que le nombre de ces sites, les charges variables, est élevé : il dépend donc des teneurs en argile et en MO.
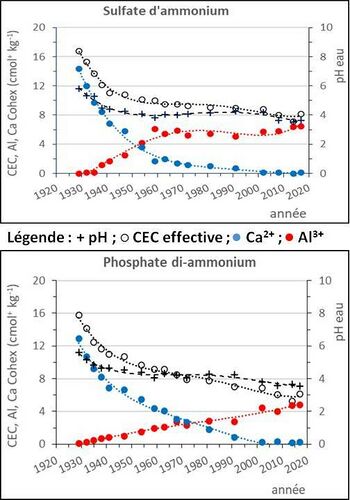
- c) pH < 5 : dans les sols très acides, le pouvoir tampon est fort. Lors de l’acidification, les H+ produits protonent les formes basiques[2] des ions de l’aluminium. Les ions de l’aluminium tamponnent fortement le pH du sol vers une valeur de 4 (courbes du pH, figure 2). L’augmentation des Al3+ est due à l’altération des aluminosilicates peu résistants (van Oort et al., 2022) : les H+ cassent les liaisons Al-O (aluminium-oxygène). L’aluminium remplace peu à peu les Ca2+ échangeables (figure 2).
Acidification des sols : présentation rapide des mécanismes
L’acidification naturelle des sols est due à des processus que nous ne détaillerons pas, processus plus ou moins modifiés par les pratiques des agriculteurs (voir Fabre et al., 2009) : la minéralisation de la matière organique (production et consommation de H+, production de CO2), la respiration racinaire (production de CO2) et l’absorption par les racines de plus de cations que d’anions, apports externes d’acides ou de bases. Elle ne se produit que si le bilan hydrique [Pluie – Évapotranspiration réelle (ETR)] annuel est positif, le lessivage entraînant hors de portée des racines les ions à l’origine de l’alcalinité. Selon les écosystèmes, le bilan des protons consommés et produits varie de 2,5 à plus de 7,5 kmol H+/ha/an (Julien et al., 2011).
La variation du pH du sol dans l’espace et dans le temps est importante. Elle est cependant plus limitée que celle du pH de la solution du sol, en raison de la diversité des microsites : taille du pore, présence de racine ou de colonie bactérienne. Cette variation obéit à quatre grandes règles :
- a) Dans les régions au climat tempéré, l’acidification du sol est inéluctable. Une baisse du pH du sol de 1 unité prend 10 à 20 ans.
- b) Dans un profil de sol, solum, le pH est souvent plus acide en surface qu’en profondeur, car l’acidification se produit surtout en surface, et les roches-mères sont généralement basiques. Le flux de protons neutralisables par les roches-mères est variable : inférieur à 0,5 kmol H+/ha/an pour un sol sur grès et supérieur à 2 kmol H+/ha/an pour un sol sur roche carbonatée (Party et al., 2001 ; Julien et al., 2011).
- c) Le plus souvent, c’est dans l’horizon superficiel que le pH du sol varie le plus au cours de l’année en raison des processus à l’origine de l’acidification. Le minimum est atteint en été, l’écart avec le maximum peut atteindre une unité pH (Fabre et al., 2009 : 48).
- d) La variation du pH dépend du pouvoir tampon du sol (voir capacité d’échange cationique). Le pouvoir tampon varie de 1 à 15 cmol H+/kg sol/unité pH (Julien et al., 2011)
Le pH du sol, un point de repère utile aux agronomes
Les agronomes utilisent le pH du sol pour caractériser rapidement l’ambiance chimique et déceler une carence ou une toxicité. Les raisons chimiques de ces carences ou toxicités sont à rechercher dans la solution du sol et à l’interface sol / solution. Le pH de la solution du sol (Bourrié & Lelong, 1994) est plus variable que le pH du sol tel que défini au début de cet article et mesuré conventionnellement dans les analyses de sol. Les agronomes observent aussi des relations entre le pH du sol et certaines propriétés physiques ou biologiques du sol. Ces relations peuvent être dues au pH du sol ou à la Capacité d’Échange Cationique (CEC) effective du sol.
Pour bien caractériser l’acidité du sol, il faut prendre en compte le pH du sol, le pouvoir tampon et la « capacité à neutraliser les acides » (voir capacité d’échange). Ces trois variables constituent ce qu’on appelle le « Statut acido-basique » du sol, SAB (Fabre et al., 2009 : 11).
Notes
- ↑ Pour les alchimistes qui cherchaient la pierre philosophale, V.I.T.R.I.O.L. signifie, dit-on, Visita Interiora Terrae Rectificando Invenies Occultum Lapidem, « visite l'intérieur de la terre et, en rectifiant, tu trouveras la pierre cachée ».
- ↑ Les ions de l’aluminium qui peuvent accepter des H+ sont : Al (OH)2+, Al (OH)2+ et A (OH)30. Les deux premiers ions, qui peuvent aussi donner des H+, sont dits amphotères.
Références citées
- Arrhenius S., 1887. Über die Dissociation der in Wasser gelösten Stoffe. Zeitschrift Phys. Chem., 1.
- Bardez E., 2010. Il y a 100 ans… naissait le pH. L’actualité chimique, n°340 : 35-41.
- Bergman T.O., 1783. Traité des affinités chymiques ou attractions électives. Paris, 1788. Texte intégral.
- Berthollet C.L., 1803. Essai de statique chimique, 1e</e> partie. Paris, 543 p. Texte intégral.
- Bonneau M., Souchier B., 1994. Pédologie 2. Constituants et propriétés du sol. Duchaufour & Souchier eds, Masson, Paris, 692 p.
- Bourrié G., Lelong F., 1994. Les solutions du sol : du profil au bassin versant. In : Bonneau et Souchier eds, Constituants et propriétés du sol, Masson, Paris : 239-273.
- Boussingault J.B., 1864. Agronomie, chimie agricole et physiologie. T. 3, 2e édition. 409 p. Texte intégral.
- Bouthier A., Castillon P., 2001. La toxicité aluminique : risque majeur lié à l’acidité dans les sols agricoles. In : D. Tessier, ed., L’acidification des sols : Origine, approche, enjeux et maîtrise, 2 p.
- Boyle R., 1661. The Sceptical Chymist: or Chymico-Physical Doubts & Paradoxes. Londres, xiv + 442 p, Texte intégral.
- Boyle R., 1675. Reflection about the hypothesis of alcali and acidum. Londres, 38 p.
- BrØnsted, J.N., 1923. Some remarks on the concept of acids and bases. Recueil des Travaux Chimiques des Pays-Bas. 42 (8) : 718–728.
- Bruckert S., Rouiller J., 1994. Mécanismes de régulation du pH des sols. In : Bonneau et Souchier eds, Constituants et propriétés du sol, Masson, Paris : 511-524.
- Charlet L., 2001. Les constituants des sols : signification de la charge électrique superficielle. In : D. Tessier, ed, L’acidification des sols : Origine, approche, enjeux et maîtrise, 2 p.
- Clark W. M., 1920. The Determination of Hydrogen Ions. Baltimore, Williams and Wilkins, 317 p.
- Davy H., 1815. On the action of acids on the salts usually called hyperoxy-muriates, and on the gases produced from them. Philosophical Transactions of the Royal Society, 105: 214-219 Texte intégral.
- Demolon A., 1932. La Dynamique du sol. Dunod, Paris, 347p.
- Duhamel du Monceau H.L., 1754. Traité de la culture des terres, contenant les Expériences & Réflexions dur la culture des Terres, faites pendant l’année 1753. Paris, t.3, LXIII + 429p. Texte intégral.
- Dulong P.L., 1815. Mémoires de l’Académie des Sciences, (1813-1815), Histoire, p. CXCVIII, cité par Ladenburg, p. 78.
- Espiau P. 1994. Le complexe absorbant. In : Bonneau et Souchier eds, Constituants et propriétés du sol. Masson, Paris : 489-510.
- Fabre B., Felix-Faure B., Bouthier A., Castillon P., Cahurel J.Y., Damay N., Julien J.-L., Duval R., Fabre A., Kalt S., Gaumont F.X., Peltier O., Steinmann J.-F., Tessier C., Ponchon F., Thibierge J., Valé M., 2009. Le chaulage, des bases pour le raisonner, version 2, Comifer, Groupe Chaulage, 111 p.
- Fabre B., Kockmann F., 2002. La pratique du chaulage, de la construction du référentiel régional à la démarche de conseil en exploitation. Étude et Gestion des Sols, 9-3 : 213-224 Texte intégral
- Franckowiak R., 2002. Les sels neutres de Guillaume François Rouelle. Revue d’Histoire des Sciences, 26p.
- Gasparin A. de, 1843. Cours d’agriculture théorique, t. 1. Paris, 732 p. Texte intégral.
- Garola C.V., 1903. Engrais. Baillière, Paris, xi + 502 p., fig. . Texte intégral.
- Geoffroy E.F., 1718. Table des différents rapports observés en Chimie entre différentes substances. In : Histoire de l'Académie royale des sciences, avec les mémoires de mathématique et de physique, Paris, 1732 : 202-212. Texte intégral.
- Hall, A. D., 1906. Le sol en agriculture. Traduit par A. Demolon. Baillère et fils, Paris. 432p.
- Hénault C., Bourennane H., Ayzac A., Ratié C., Saby N.P.A., Cohan J.P., Eglin T., LeGall C., 2019. Management of soil pH promotes nitrous oxide reduction and thus mitigates soil emissions of this greenhouse gas. Scientific reports, 9 : art.20182, 11p.
- ISO 10390, 2005. Qualité du sol – Détermination du pH.
- ITB, 2017. 2016, une année révélatrice de l’état acido-basique des parcelles. La Technique betteravière. Le Betteravier français, n° 1056 : 31-33.
- ITB, 2020. Le statut acido-basique du sol pour la betterave sucrière. Rapport de synthèse. 15 p.
- Julien J.-L., Charlet L., Dambrine E., Delvaux B., Dufey J-E., Fardeau J-C., Le Cadre E., Tessier D., 2011. L’acidification des sols. In : Girard, Walter, Rémy, Berthelin, Morel, eds, Sols et Environnement. Dunod : 402-426.
- Juste C., 1966. Contribution à l’étude de la dynamique de l’aluminium dans les sols acides du Sud-Ouest atlantique : application à leur mise en valeur. Thèse faculté des sciences de Nancy, 143 p.
- Kockmann F., Fabre B., 1989. Chaulage et modifications de la fertilité physique en sols limoneux hydromorphes. In : Dodd & Grace, eds, Agricultural Engineering, vol. 3. Balkerna, Rotterdam: 1817-1823.
- Ladenburg A., 1909. Histoire du développement de la chimie depuis Lavoisier jusqu'à nos jours. Traduit sur la quatrième édition allemande par A. Corvisy. Paris. Texte intégral.
- Lambert A., 2018. L’analyse de sol, indispensable au pilotage optimal des cultures. Cultivar, 4 septembre.
- Lavoisier, A. L. de, 1778. Considérations générales sur la nature des acides. Mémoires de l’Académie des Sciences, 248-260. Texte intégral.
- Lewis G. N., 1907. Outlines of a New System of Thermodynamic Chemistry. Proc. Am. Acad. Arts. Sci., 43 (7):259-293. [https://www.biodiversitylibrary.org/item/22205#page/283/mode/1up Texte intégral}.
- Lewis G. N. 1923. Valence and the structure of atoms and molecule. New York: The Chemical Catalog Co., Inc. 172p. Texte intégral.
- Liebig J., 1837. Introduction à l'étude de la chimie : contenant les principes généraux de cette science, les proportions chimiques, la théorie atomique... trad. de l'allemand, par Ch. Gerhardt, xii + 248 p. Texte intégral.
- Liebig J., 1838. Sur la constitution des acides organiques. Annales de chimie et de physique, vol. 68 : 1-93. Texte intégral.
- Liger L. et B., 1721. La nouvelle Maison rustique ou Economie générale de tous les biens de campagne... 3e éd., Paris, t. 1, 782 p. Texte intégral.
- Loué A., 1987. Les oligo-éléments en agriculture. Éditions de la nouvelle librairie (IS). 339p.
- Lowry T. M., 1923. The uniqueness of hydrogen. Journal of the Society of Chemical Industry, 42: 43-47.
- McBride M.B., 1994. Environmental chemistry of soils. Oxford University Press, 406 p.
- Metzger H., [1922] 1969. Les doctrines chimiques en France du début du XVIIe à la fin du XVIIIe siècle. Blanchard, Paris, 496 p. Édition 1923 Texte intégral.
- Ouertatani L., Dumon A., 2007. Évolution historique des concepts d’acide et de base. L’actualité chimique, 9 p.
- Party J.-P., Probst A., Thomas A.-L., Dambrine E., 2001. Charges critiques d'acidité en polluants atmosphériques en France : conséquences vis-à-vis des sols et des peuplements forestiers. Pollutions atmosphériques, n°172 : 519-527.
- Rouelle G.F., 1744. Mémoire sur les sels neutres, dans lequel on propose une division méthodique de ces sels, qui facilite les moyens pour parvenir à la théorie de leur crystallisation. In : Histoire de l’Académie royale des sciences pour l’année 1744, Paris, 1748 : 353-364. Texte intégral.
- Rouelle G.F., 1754. Mémoire sur les sels neutres, dans lequel on fait connaître deux nouvelles classes de sels neutres, & l’on développe le phénomène singulier de l’excès d’acide dans ces sels. In : Histoire de l’Académie royale des sciences pour l’année 1754, Paris, 1759 : 572-588. Texte intégral.
- Rozier F. (Abbé), 1796. Cours complet d’agriculture théorique, pratique, économique, et de médecine rurale et vétérinaire, suivi d’une Méthode pour étudier l’Agriculture par Principes, ou Dictionnaire universel d’agriculture. Paris, t. 9, 675 p. Texte intégral.
- Ruellan A., Delétang J., 1967. Les phénomènes d’échange de cations et d’anions dans les sols. Initiations - documentations techniques, n°5. Orstom, Paris. 123p. [1].
- Saby N.P.A., Lemercier B., Arrouays D., Leménager S., Louis B.P., Millet F., Paroissien J.-B., Schellenberger E., Squividant H., Swiderski C., Toutain B., Walter C., Bardy M., 2014. Le programme Base de Données des Analyses de Terre (BDAT) : Bilan de 20 ans de collecte de résultats d’analyses. Étude et Gestion des Sols, 21 : 141-150. Texte intégral.
- Saint André F. de, 1672. Entretiens sur l’acide et l’alkali. Paris. [Entretiens-sur-l-acide-et-sur-l-alkali-i.pdf (univ-lille.fr Texte intégral].
- Ségalen P., 1973. L’aluminium dans les sols. Initiations - Documentations techniques, n° 22. Orstom, Paris, 281 p. Texte intégral.
- Serres O. de, [1600] 1804. Le théâtre d’agriculture et mesnage des champs… t. 1. Nouvelle édition, publiée par la Société d’Agriculture du Département de la Seine, Paris, CXCII + 672 p., fig. HT. Texte intégral.
- Sørensen S., 1909. Enzymstudien. II: Mitteilung. Über die Messung und die Bedeutung der Wasserstoffionenkoncentration bei enzymatischen Prozessen. Biochemische Zeitschrift, vol 21: 131–304.
- Sørensen S.P.L., Linderstrøm-Lang K., 1924. On the determination and value of π0 in electrometric measurement of hydrogen ion concentrations. C.R. Trav. Lab. Carlsberg, 15, n° 1.
- Thaër A. von, Principes raisonnés d’agriculture. Traduction de EVB Crud, Paris & Genève. t. 2, 1812, XXVI + 273 p. Texte intégral. t. 3, 1814, 304 p. + planches HT. Texte intégral.
- Thénard L.J., Gay-Lussac L.J., 1809a. Des propriétés de l'acide fluorique. Mémoire de physique et de chimie de la société d'Arcueil. Tome 2 : 317-331.
- Thénard L.J., Gay-Lussac L.J., 1809b. De la nature et des propriétés de l'acide muriatique et de l'acide muriatique oxygéné. Mémoire de physique et de chimie de la société d'Arcueil. T. 2 : 339-358. Texte intégral.
- van Oort F., Paradelo R., Baize D., Chenu C., Delarue G., Guérin A., Proix N., 2022. Can long-term fertilization accelerate pedogenesis? Depicting soil processes boosted by continuous annual NPK-inputs on a bare loess Luvisol since 1928 (INRAE-Versailles, France). Geoderma, 416.