Lixiviation
Auteur : Denis Baize et Pierre Morlon
| Le point de vue de... | |
|---|---|
Pas de compléments pour cet article
| |
| Annexes de l'article | |
| Voir aussi (articles complémentaires) | |
| Autres langues | |
| Anglais : | lixiviation |
| Allemand : | Auswaschung |
| Espagnol : | lixiviación |
| Informations complémentaires | |
Article accepté le 17 février 2026
| |
| Article mis en ligne le 17 février 2026 | |
Définition
Au sens général, lixiviation est un terme technique employé en chimie et dans diverses industries :
Ce solvant peut être l’eau (chaude), par exemple pour extraire le jus sucré des cossettes de betteraves… ou pour faire un café « expresso » (Trésor de la langue française).
En agronomie et pédologie, le mot désigne un phénomène naturel qui se produit in situ dans le sol[1]. En voici la définition très complète, sous deux formulations :
« Lorsqu’un nutriment est présent sous forme dissoute dans la solution du sol, non retenu par le complexe d’échange ou par des liaisons plus fortes avec les minéraux, et que la pluviométrie excède les prélèvements d’eau par les plantes et les pertes d’eau par évaporation, il a de fortes chances d’être lixivié.
La lixiviation est donc particulièrement importante dans les zones à climat pluvieux, et surtout dans les cas où le sol est à nu pendant des périodes pluvieuses et où il n’y a pas de racines pour prélever les nutriments et les maintenir ainsi dans l’écosystème. Elle affecte particulièrement des ions comme le nitrate, les formes organiques solubles d’azote ou dans une moindre mesure le potassium, qui ne se fixent que peu aux minéraux du sol et au complexe d’échange et sont donc mobiles, faciles à entraîner. Elle n’affecte par contre que peu les phosphates qui sont trop peu mobiles. Mais les flux les plus importants de nutriments lixiviés concernent généralement les cations comme le calcium et le magnésium : c’est alors un symptôme de l’acidification des sols ».
Connaissances scientifiques et enjeux dans les sociétés, au cours du temps (voir annexe 1)
Cela fait très longtemps que les écrivains en agriculture mentionnent l’existence de ce que nous appelons lixiviation, en indiquant les circonstances dans lesquelles elle se produit. Mais les enjeux auxquels elle est associée ont récemment radicalement changé : pendant des siècles, il s’agissait de ne pas laisser perdre une précieuse ressource ; de nos jours il s’agit surtout de ne pas polluer les eaux souterraines.
Le fumier et les « sels »
Le plus ancien texte que nous ayons trouvé sur le sujet est tiré du premier traité de pratique agricole publié en langue anglaise, Husbandry de Fitzherbert, seigneur d’un domaine dans le Derbyshire.
And yf the lande be falowed in wynter tyme, it is farrre the worse, for the principal causes, one is, all the rayne that commeth shal washe the lande, and dryue awaye the donge, and the good moulde, that the lande shall be moche the worse. (Fitzherbert, [1525] 1767 : 17-18). |
Et si la terre est jachérée [labourée] en hiver, c’est de loin le pire ; des principales raisons, l’une est que toute la pluie qui vient va laver la terre, et enlever le fumier et la bonne terre, et ainsi la terre sera de beaucoup pire. |
L’essentiel y est déjà : la pluie qui tombe sur le sol nu en hiver le lave et lui enlève le fumier et ce qu’elle a de bon. En Écosse deux siècles plus tard, Mackintosh écrit : « Nous, comme nous étudions les moyens efficaces d’appauvrir notre terre, en retournons et exposons la face charnue toute crue aux pluies et inondations de l’hiver, pour faire partir au lavage le peu de sels et d’esprits que nos récoltes ininterrompues y ont laissés » (We, as we study the effectual Means of impoverishing our Land, turn up the raw fleshy Side to the Winter Rains and Floods, to have the few Salts and Spirits, our many successive unintermitting Crops have left in it, wash’d away.) (1729 : 46).
En France, Bernard Palissy écrit en 1563 « Tout ainsi que tu vois que les eaux qui passent à travers des terres salpestreuses, emportent avec elles le salpestre, et apres que les eaux ont passé par lesdites terres, lesdites terres ne peuvent plus servir à faire salpestre, car les eaux qui ont passé, ont emporté tout le sel », décrivant ainsi l’entraînement par l’eau d’une substance soluble, alors exploitée comme explosif plutôt que comme engrais (en l’occurrence, mais il ne le savait pas, du nitrate de potassium).
Au XVIIIe siècle, on parle du lavage ou de la descente en profondeur des « sels » nutritifs, un mot au sens alors très vague :
« Il y a des personnes qui prétendent que pour aider aux racines à faire pousser au tronc des arbres de beaux jets, il suffisait de mettre au fond du trou quelque amendement, dont les sels fussent capables de les faire pousser avec vigueur, & qu’il n’était pas besoin d’en mettre au-dessus des racines. Pour moi, j’estime qu’elles se trompent, (…) car les sels qu’il [cet amendement] contient, descendent toujours & tendent à leur centre à cause de leur pesanteur. » (Angran de Rueneuve, 1712 : 214-215).
« … on peut espérer une bonne Récolte en tout genre, parce que la terre s’est reposée, & qu’elle ne s’est point fatiguée à pousser inutilement de trop bonne heure : tous les sels y sont ; ils n’ont point été lessivés par des pluies trop abondantes, & prématurées. » (Quesnay, 1759 : 44).
L’azote rare ; ses pertes connues par l’analyse des eaux de drainage
| « il reste établi que tout élément immédiatement actif d’un engrais est soluble, et que, par conséquent, un sol fumé, quand il est exposé à des pluies continuelles, perd une portion plus ou moins forte des agents fertilisants qu’on lui a donnés ; aussi trouve-t-on constamment dans l’eau de drainage, véritable lessive du terrain, des sels ammoniacaux et surtout des nitrates » (Boussingault, 1860 : 387.). |
Les premières analyses faites à Rothamsted en Angleterre révèlent l’ampleur des pertes en composés azotés (principalement nitrates), alors rares et chers, et qu’on ne savait pas encore synthétiser. Sabatier en 1890 (voir annexe 2) et Dehérain en 1892 exposent les connaissances de l’époque sur le sujet, que nous avons résumées ainsi (Morlon, 1998) :
« Le lessivage des nitrates vers 1900. Les nitrates perdus par lessivage sont produits par la minéralisation de l’humus du sol après la récolte. Ils sont entraînés par les eaux excédentaires drainant en période hivernale, à une époque où les prélèvements par la végétation sont faibles. Les pertes sont plus abondantes dans les sols peu épais et perméables, en l’absence de végétation (sol nu, jachère) et après labour ou épandage de fumier. Elles sont réduites ou nulles sous une végétation permanente (prairies, forêts) et/ou profondément enracinée.
Le code de bonnes pratiques agricoles, vers 1905.
- 1. Pas de sols nus en hiver : cultures intermédiaires.
- 2. Pas d’engrais minéraux à l’automne.
- 3. Apports minéraux au printemps, fractionnés suivant les besoins de la végétation.
- 4. Raisonner la fumure organique sur « une série d’un certain nombre d’années ».
- 5. sur sols filtrants et peu profonds, apports de fumier à doses faibles mais fréquentes.
- 6. Récupérer les eaux de drainage chargées en nitrates pour arroser les prairies. ».
Ces connaissances sont alors enseignées à l’école primaire à tous les enfants de France, et ce qu’en disaient les manuels scolaires de l’époque mérite d’être cité :
« Les engrais solubles que les terres sableuses renferment sont, à la moindre pluie, entraînés dans le sous-sol. Il ne faut jamais y mettre qu’une petite quantité d’engrais à la fois, et répéter souvent cette opération » « Tous les nitrates sont solubles dans l’eau (...) les eaux de pluie peuvent les entraîner dans les profondeurs du sol où ils sont perdus ». « Si l’azote nitrique n’est pas absorbé par les racines des plantes, il est entraîné dans les sources par les eaux pluviales (...) La Seine (...) entraîne chaque année dans la mer une quantité d’acide nitrique qui peut être évaluée à 19 000 t, ce qui correspond à plus du tiers de la quantité d’azote nitrique que la France importe chaque année sous forme de nitrate de soude ». « LECTURE À EXPLIQUER. Les nitrates sont le produit de la nitrification de la matière organique et de l’ammoniaque. Ils échappent complètement à la terre, qui n’exerce pas sa faculté absorbante à leur égard. Aussi convient-il, quand on emploie les nitrates comme engrais, de les donner à l’époque où la végétation est en activité et peut les assimiler à bref délai ; autrement ils risquent d’être perdus pour les plantes » (Th. Schlœsing, Membre de l’Institut) » (Barillot, 1896 et 1897).
« Nitrate de soude. (...) On l’emploie au printemps, sur les céréales qui ont souffert des froids de l’hiver, le plus souvent en couverture, c’est-à-dire sans le mêler au sol par un labour. - Si on l’employait à l’automne, il serait rapidement entraîné dans le sous-sol par les pluies, car il est très soluble et le pouvoir absorbant[2] de la terre est sans action sur lui. » (Dutilleul & Ramé, ca. 1910 : 176).
L’azote en excès : la pollution des nappes phréatiques
Ces connaissances et ces recommandations ont été « oubliées » après la 1re guerre mondiale, quand la France fut en mesure de faire industriellement la synthèse chimique de l’ammoniac par les procédés Haber-Bosch (récupéré sur l’Allemagne) et Claude. Désireuses d’accroître les volumes transportés (engrais dans un sens, produits récoltés dans l’autre), les compagnies de chemin de fer créèrent des stations agronomiques qui se gardèrent de les diffuser.
Plus tard, deux phénomènes conduisirent à la présence dans le sol de quantités d’azote non captées par les plantes et donc lixiviées vers les eaux souterraines. D’une part, le rapport entre les prix des engrais azotés et ceux des produits récoltés favorisa la pratique d’une fertilisation dite « d’assurance » : mettre une dose d’azote telle que la culture n’en manque jamais, quitte à ce qu’il y en ait trop quand (ou là où) le rendement est plus faible que prévu (voir l’annexe 4 de l’article Raison, rationnel et Cie : mots piégés). D’autre part, pour alimenter le bétail, des prairies permanentes furent remplacées par du maïs : la minéralisation de la matière organique de la prairie après retournement faisant brutalement déstocker l’azote, et la récolte tardive du maïs rendant difficile un semis d’automne ensuite, laissant le sol nu en hiver.
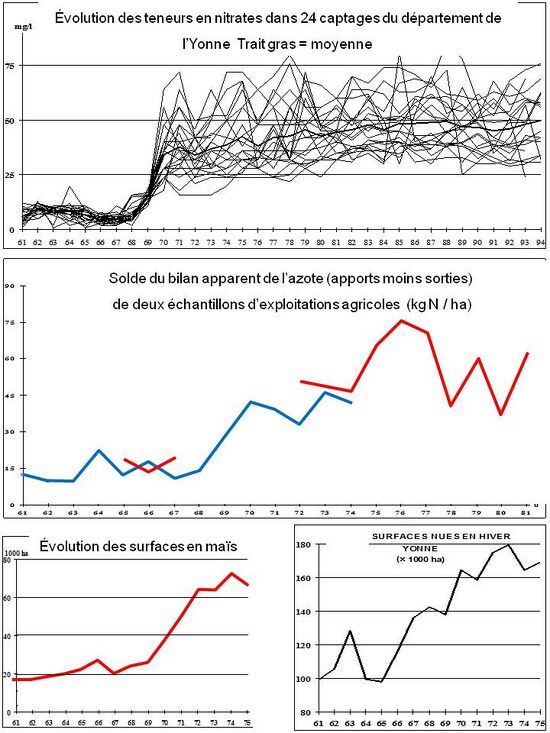
Là où ces deux phénomènes ont coïncidé dans le temps, ils ont provoqué une brusque augmentation des taux de nitrates dans les eaux souterraines, comme dans le département de l’Yonne à la fin des années 1960[3] (Chrétien et al., 1974 ; Morlon et al., 1998) (fig. 2)
Cela conduisit à la réapparition de ces connaissances et recommandations au troisième quart du XXe siècle (Hénin, 1980 ; Sebillotte, 1992), quand la lixiviation des excès d’azote, polluant les nappes souterraines, devint une préoccupation majeure (voir annexe 3)
« L’agriculteur réalise des apports réguliers d’azote, dans le but d’atteindre ses objectifs de production. La totalité de l’azote apporté n’est cependant pas valorisée par les plantes, notamment en raison de transferts à l’extérieur du système cultivé. Ces pertes représentent un impact économique. Elles ont également des conséquences négatives pour l’environnement ou pour l’usage de l’eau. Les impacts négatifs sont en particulier causés par le nitrate (NO3-), l’ammoniac (NH3) et le protoxyde d’azote (N2O). Ces formes d’azote ont pour conséquence une dégradation de la qualité des eaux de boisson (NO3–), une augmentation de l’eutrophisation (NO3–, NH3), une réduction de la biodiversité en favorisant les espèces nitrophiles (NO3–, NH3), ainsi qu’une contribution à l’effet de serre (N2O) et à l’acidification des sols (NH3) » (Reau et al., 2015).
Autres substances en solution susceptibles de polluer eaux de surface et eaux souterraines
La lixiviation peut également entraîner des produits phytosanitaires et leurs métabolites (Barriuso et al., 1996 ; Pirlot et al., 2022).
« Les produits phytosanitaires ou pesticides agricoles sont très efficaces pour préserver la productivité des cultures, mais leurs effets sont plus qu’indésirables lorsqu’on les retrouve en dehors de l’écosystème agricole dans lequel ils ont été mis en œuvre. La déperdition de pesticides représente un gâchis à plus d’un titre : elle entraîne une perte de rendement, un surcoût pour l’utilisateur et cause des dommages à l’environnement auquel ces pesticides n’étaient pas destinés. La pollution diffuse due aux pesticides agricoles est communément considérée comme l’une des causes majeures de pollution des eaux superficielles ».
« Il existe essentiellement deux moyens pour des pesticides épandus dans les règles de l’art d’atteindre les eaux superficielles et souterraines : le ruissellement et la lixiviation. Le ruissellement se définit comme le transport physique de polluants sur la surface du sol par l’eau de pluie qui s’y écoule. La lixiviation est le processus par lequel la pluie ou l’eau d’irrigation qui s’infiltre lentement dans le sol entraîne avec elle des polluants » (Projet ArtWet, programme LIFE 06 ENV, 2010).
Cette pollution diffuse pouvant également affecter les nappes phréatiques est donc susceptible d’avoir un impact négatif sur la qualité des eaux destinées à l’alimentation humaine.
Enfin, l’épandage de boues d’épuration sur des terrains agricoles est susceptible de libérer des substances indésirables telles qu’antibiotiques ou perturbateurs endocriniens. Cependant la réglementation française en cours (arrêté du 8 janvier 1998[4]) impose un certain nombre de précautions (zones d’épandage interdites, sols inaptes à l’épandage, etc.
Dans le contexte du dérèglement climatique, avec notamment des précipitations plus intenses, la lixiviation de substances indésirables vers les eaux profondes risque de s’aggraver. Toutes les mesures de précaution évoquées ci-dessus et dans l’annexe 3 seront d’autant plus nécessaires.
Aspects positifs de la lixiviation dans les sols : la désalinisation
Les eaux avec lesquelles on irrigue les cultures contiennent toujours des sels dissous – avec des concentrations extrêmement diverses d’une région à l’autre. En climat humide, elles sont « douces » = très faiblement chargées. Dans les régions sèches, elles sont souvent puisées dans des nappes phréatiques salées ou proviennent de rivières alimentées par du ruissellement sur des terrains plus ou moins salés.
En s’évaporant ou étant transpirées par les plantes (évapotranspiration), elles laissent ces sels dans le sol, tendant à en augmenter la salinité à chaque irrigation. Cette tendance, très défavorable à long terme, peut être contrecarrée par le lavage du sol par de l’eau douce (une lixiviation) qui désalinise le sol, de façon différente selon le climat.
Là où les pluies sont suffisamment abondantes (à au moins un moment dans l’année) pour que leur eau descende en-dessous de la zone racinaire, cette lixiviation se fait naturellement, sans intervention humaine et sans poser de problème car les concentrations sont faibles.
Dans les zones arides à semi-arides où les précipitations sont insuffisantes, il est nécessaire d’inonder artificiellement avec de l’eau douce… à condition d’en disposer à un moment dans l’année ! Là où ce n’est pas possible, les sols se salinisent irrémédiablement au cours du temps.
Quand l’eau qui a lavé le sol est chargée en sels, il faut qu’elle soit évacuée par un drainage efficace pour éviter qu’elle alimente la nappe phréatique (et/ou remonte éventuellement ensuite à la surface sous l’effet de l’évaporation). Ce drainage n’est possible que là où la topographie le permet : en climat sec, les dépressions fermées sont condamnées à la salinisation.
Lixiviation versus lessivage
| « En agriculture, on emploie souvent à tort les termes de lixiviation et lessivage dans le même sens. La lixiviation concerne uniquement les éléments solubles puisqu’ils sont entraînés verticalement par infiltration après avoir été dissous. Le lessivage concerne uniquement les particules solides non solubles. Ainsi, il y a lixiviation des nitrates et lessivage des argiles. » ((Lixiviation sur Wikipedia.). |
Lessivage et lixiviation dérivent tous deux du latin lix (eau mêlée de cendre, servant à la lessive), le premier sur la longue durée par l’évolution spontanée de la langue, le second est un mot savant apparu peu avant 1700.
Ces deux termes ont longtemps été confondus, et ils le sont encore souvent. Voici quelques exemples.
« Dans les sols un rôle fondamental appartient à l’humus. Ce dernier est par excellence un agent fixant énergiquement comme la végétation elle-même, les cations qui entrent dans la constitution des éléments basiques du sol. Il protège donc ce dernier de l’entraînement de bases[5] par lessivage. (…) Nous avons indiqué le rôle de l’eau dans la décomposition des silicates ; elle est aussi l’agent de la migration des produits d’altération. On conçoit que si les pluies sont supérieures à l’évaporation, il en résulte une lixiviation, c’est-à-dire un entraînement de haut en bas » (Demolon, 1932 : 29).
« Cet entraînement de haut en bas des éléments constitutifs du sol se nomme lessivage ou lixiviation. Ce lessivage vertical provoque la décalcification, la destruction des colloïdes et l’acidification du sol. » (Mailloux & Godbout, 1954).
« Lixiviation : À peu près synonyme de lessivage mais impliquant l’idée d’épuisement » (Plaisance & Cailleux, 1958).
« LESSIVAGE (…). Pédol. Migration des substances solubles (carbonates, cations, sels métalliques) dans les interstices du sol. » (Habault, 1983)
Pour bien distinguer la lixiviation de substances solubles, du lessivage des particules argileuses en évitant toute ambiguïté, le plus sûr est, pour désigner ce dernier, d’employer les néologismes « illuviation d’argile » ou « argilluviation ».
Notes
- ↑ Il ne sera pas question ici de la lixiviation des ordures et déchets stockés en décharges.
- ↑ Pouvoir absorbant : « propriété qu’a la terre arable d’absorber et de retenir les éléments fertilisants, dissous dans l’eau, comme la potasse, l’ammoniaque, etc. ». Aujourd’hui on parle d’un « pouvoir adsorbant » car il s’agit bien d’une adsorption.
- ↑ Coïncidant avec un renouvellement de génération des agriculteurs, accéléré par les Indemnités viagères de Départ, l’augmentation de la surface moyenne des exploitations ainsi que de la puissance de traction mécanique par 100 ha de Surface Agricole Utile.
- ↑ Complété par les circulaires d’application des 16 mars 1999 et 18 avril 2005.
- ↑ En réalité, les cations Ca++, Mg++, K+ et Na+ ne sont pas des bases mais plutôt des acides. (Voir l’article Cations échangeables du sol)
Références citées
- Alletz P.A., 1760. L’agronome, ou dictionnaire portatif du cultivateur contenant toutes les connaissances nécessaires pour gouverner les Biens de la Campagne, & les faire valoir utilement ; pour soutenir ses droits, conserver sa santé, & rendre gracieuse la vie champêtre. Paris, t. 2, 664 p. Texte intégral sur Gallica.
- Angran de Rueneuve, 1712. Observations sur l'Agriculture et le Jardinage, pour servir d’Instruction à ceux qui désireront s’y rendre habiles. Paris, t. 1, xiii + 384 + 22 p. Texte intégral sur Gallica.
- Barillot V., 1896. Notions de sciences avec leurs applications. L'agriculture à l'usage des écoles primaires. 6e édition. Belin, Paris, 252 pp.
- Barillot V., 1897. Cours élémentaire d’agriculture, à l’usage de l’enseignement primaire supérieur et de l’enseignement secondaire moderne. 4e édition. Belin, Paris, 432 p.
- Barriuso E., Calvet R., Schiavon M., Soulas G., 1996. Les pesticides et les polluants organiques des sols. Transformations et dissipation. Étude et Gestion des Sols, N° spécial « le sol un patrimoine menacé », Paris octobre 1996, pp. 279-295. Texte intégral sur le site de l’AFES.
- Boussingault, 1860. Agronomie, chimie agricole et physiologie. 2de édition, t. 1, 396 p. Texte intégral sur Gallica.
- Chrétien J., Concaret J., Mère C. Évolution des teneurs en nitrates dans les eaux d'alimentation (département de l'Yonne). Ann. agron., 1974, 25 (2-3) : 499-513.
- C.I.L.F. (Conseil International de la langue française), 1999. Dictionnaire d’agriculture français – anglais – allemand. CILF, Paris, 1012 p.
- Dehérain P.P., 1892. Traité de chimie agricole. 2e édition, Masson, Paris, 916 p. Texte intégral sur Gallica.
- Demolon A., 1932. La dynamique du sol. Dunod, Paris. 347 p.
- Dutilleul J., Ramé E., ca. 1910. Les sciences physiques et naturelles, avec leurs applications à l’Agriculture, à l’Industrie, à l’Hygiène et à l’Économie domestique. Enseignement primaire, cours moyen et supérieur. Larousse, Paris, 288 p.
- Fitzherbert J., [1525] 1767, The Booke of Husbandry. London. Édition de 1534 sur le projet Gutenberg.
- Habault P., 1983. Lexique de termes agricoles et horticoles. Termes scientifiques, techniques et économiques. J.B. Baillière, Paris, 1983, 152 p.
- Hénin S., 1980. Rapport du groupe de travail Activités agricoles et qualité des eaux. Ministère de l’agriculture, ministère de l’Environnement, Paris, 58 p.
- Institut Agro Montpellier. Texte intégral
- Mackintosh W., 1729. An Essay on Ways ans Means for Inclosing, Fallowing, Planting, &c. Scotland... Edinburgh, 392 p. Texte intégral sur archive.org.
- Mailloux A., Godbout G., 1954. Étude Pédologique des sols des comtés de Huntingdon et Beauharnois. Province de Québec - Ministère de l’agriculture. Bulletin technique N° 4, 221 p.
- Morlon P. 1998. Vieilles lunes ? Les normes pour les bâtiments d’élevage ont 150 ans, le code de bonnes pratiques agricoles en a 100... Courrier de l’Environnement de l’INRA, 33 : 45-60. Texte intégral sur hal.science.
- Morlon P., Trouche G., Soulard C., Maigrot J.-L., Guyard P.-O., 1998. Diagnostic de la pollution azotée de l’eau par approche historique multi-échelles. Une étude de cas dans le département de l’Yonne (France). Cahiers Agricultures, 7 (1) : 15-27. Texte intégral (850 Ko) ; Texte intégral sur le site de la revue (27 Mo).
- Palissy B., 1563. Recepte veritable, par laquelle tous les hommes de la France pourront apprendre à multiplier et augmenter leurs trésors... Texte intégral sur Gallica. Réédition : Droz, Genève, 1988.
- Pirlot C., Blondel A., Krings B., Pigeon O., Degré A., 2022. Prévention des contaminations des eaux souterraines : étude de la lixiviation des pesticides au sein d’un sol limoneux typique de Wallonie. 50e Congrès du Groupe Français de recherches sur les Pesticides, Namur, Belgique.
- Plaisance G., Cailleux A., 1958. Dictionnaire des sols. La maison rustique, Paris. vii + 604 p.
- Projet ArtWet. 2010. Programme LIFE 06 ENV. Réduction de la pollution diffuse due aux produits phytosanitaires et phytoremédiation dans les zones humides artificielles. 111 p. Texte intégral sur le site de l’OFB.
- Quemada B. (dir), 1983. Trésor de la Langue Française. Dictionnaire de la langue du XIXe et du XXe siècle (1789-1960). CNRS, Paris, Texte intégral sur le site de l’ATILF.
- Quesnay F., 1759. Essai sur l’Administration des terres. Paris, viii + 203 p. Texte intégral sur Gallica.
- Reau R., Parnaudeau V., Dubrulle P., Aubert C. et al., 2015. Diagnostic des pertes d’azote à l’échelle du système de culture avec SYST’N. Texte intégral sur le site du COMIFER.
- Sabatier P., 1890. Leçons élémentaires de chimie agricole. Paris & Toulouse, 347 p. Texte intégral sur Wikisource ; Texte intégral sur Gallica.
- Sebillotte M., 1992. Pratiques agricoles et fertilité du milieu. Économie rurale, 208-209, L’agriculture et la gestion des ressources renouvelable : 117-124. Texte intégral sur Persée.
- Trésor de la langue française. Voir Quemada (dir.), 1983.