Capacité d'échange cationique du sol
Auteur : Jean-Luc Julien, Guilhem Bourrié, Ary Bruand, Christian Feller, Daniel Tessier et Folkert van Oort
| Le point de vue de... | |
|---|---|
Pas de compléments pour cet article
| |
| Annexes de l'article | |
| Voir aussi (articles complémentaires) | |
| Autres langues | |
| Informations complémentaires | |
Article accepté le 15 juin 2022
| |
| Article mis en ligne le 15 juin 2022 |
Définition
La capacité d’échange cationique, CEC, est la quantité totale de charges négatives du sol. Sur ces charges négatives s’adsorbent les cations, chargés positivement, qui s’échangent continuellement avec ceux de la solution du sol. Deux types de CEC sont couramment déterminées : la CEC « effective », c’est-à-dire au pH du sol en place, et la CEC à pH 7, où le pH de l’échantillon de sol est porté artificiellement à une valeur proche de 7.
Depuis un colloque sur la capacité d’échange cationique (Amiet, 1987), la CEC est devenue un terme souvent utilisé par les agronomes français pour caractériser un sol, un peu moins que la texture, la teneur en matière organique (MO), le pH du sol et les cations échangeables. Cette détermination, avec la méthode Metson à pH 7 (1956), est faite dans près de 80% des analyses de terre demandées par les agriculteurs (Saby et al., 2014). Les agronomes utilisent la CEC Metson pour caractériser le réservoir sol en cations échangeables et pour calculer d’éventuels apports d’amendements basiques. Depuis les années 2000, les chercheurs préfèrent la CEC effective au pH du sol (Orsini & Rémy, 1976).
Histoire des connaissances sur la capacité d’échange
La représentation qu’ont les agronomes de l’acidité du sol et leur compréhension des processus qui y sont associés ont profondément évolué en 300 ans. Le pH du sol, les cations échangeables et la capacité d’échange illustrent cette évolution et ils sont historiquement liés : il est donc utile de lire ces trois définitions, si possible dans cet ordre. Leur histoire est abordée ici du point de vue des agronomes français. Les relations avec la nutrition des plantes ne sont pas traitées.
Les constituants du sol à l’origine de la capacité d’échange
La mise en évidence de l’échange de cations date de 1850 (voir Cations échangeables du sol) : Way identifie que l’argile est à l’origine du phénomène d’échange de cations. S. Johnson (1859) établit expérimentalement que la MO adsorbe plus de NH4+ que l’argile. Schlœsing observe que « l’argile et les humates contractent une de ces combinaisons non définies » (1874 : 538), ce qu’on appellera le complexe argilo-humique. Garola insiste sur la nécessité « d’un pouvoir absorbant du sol suffisant pour fixer les engrais solubles » et précise que « l’argile et l’humus sont les principes immédiats des sols qui jouissent de cette propriété si importante de fixer sur leurs particules, par affinité capillaire, les bases des sels solubles des engrais » (1903 : 28). Hall note que « l’absorption est en partie de nature chimique… et en partie de nature physique et dépend de la surface que présentent les particules du sol » (1906 : 307). Demolon explique que la nature colloïdale de l’argile permet des « combinaisons avec les sels » (1911) et, dans sa thèse, note que l’argile est un « suspensoïde électronégatif » (1926 : 94). Le mécanisme à l’origine de l’adsorption n’est alors pas encore identifié.
Si les cations, chargés positivement, s’adsorbent sur certains constituants du sol, c’est parce que ces derniers portent des charges négatives. L’attraction entre deux corps de charges opposées a été étudiée dès 1785 par Coulomb. Un premier modèle de la distribution des ions au voisinage d’une surface chargée dans une solution aqueuse est établi par Helmholtz en 1879 : le modèle dit de la double-couche. Il est amélioré indépendamment par Gouy (1910) et Chapman (1913), puis par Stern (1924).
Hissink, en s’appuyant sur ce modèle, émet l’hypothèse que l’adsorption est due à « l’attraction chimique » entre des ions de charge opposée : l’argile et la MO chargées négativement et les cations chargés positivement (1925 : 553-554). Il est le premier à avoir conceptualisé la notion de capacité d’échange cationique, « la quantité totale « T » de cations que le sol est capable d’adsorber » (1925 : 554-556).
Dans son chapitre sur le pouvoir « absorbant » des sols, Demolon regrette « ce terme consacré (absorbant) par l’usage » (1932 : 210). C’est sans doute l’article récent de Mc George (1931) qui le convainc que la MO participe à l’échange de cations (id. : 218). Il note que la « capacité de saturation » de la MO est beaucoup plus élevée que celle de l’argile (id. : 218). Il utilise ainsi, pour ce que l’on appellera la CEC, une expression originale influencée par les idées de Hissink. Il pense que « la capacité de saturation est constante, indépendante de la nature des ions fixés » (id. : 216).
Découverte des propriétés de l’échangeur sol
L’argile et les cations sont hydratés
En 1886, Mendeleïev émet l’idée de l’hydratation des molécules dissoutes (cité par Petit, 2013 : 242). Puis Lewis (1916 : 775) suggère la nature polaire de la molécule d’eau qui explique l’hydratation, ou solvatation, des ions.
Étudiant la stabilité structurale des sols, Russell reprend la notion d’hydratation des ions : « les molécules d’eau possèdent un moment dipolaire et tendent à être orientées » autour des ions, comme l’argile ou les cations (1934 : 361 ; figure 1, a). Interprétant la théorie de la double-couche, il précise : « il est raisonnable d’assumer qu’un certain nombre de cations vont partager leur enveloppe de molécules d’eau orientées avec deux particules d’argile » (1934, figure 1, b). Hénin, dans sa thèse sur la stabilité structurale, reprend le schéma de Russell, oubliant les charges négatives de l’argile (1938, figure 16, p 52). Hénin n’adopte pas les vues de Russell sur la présence de molécules d’eau, alors qu’il est convaincu que la stabilité structurale dépend à la fois « de la cohésion du sol et de son affinité pour l’eau » (id : 65). Comme tous les agronomes français de l’époque, il n’a pas compris que l’échange de cations est fondé sur des particules de charges opposées. Cette vision originale des liaisons argile / cations par Russell ne sera que rarement reprise (voir annexe 1).
Grâce à l’utilisation d’une nouvelle technique d’étude des argiles, la diffraction des rayons X, la structure des argiles est découverte par Hendricks et Fry (1930) et Kelley et al. (1931) (Thomas, 1977).
Le nombre de charges varie avec le pH
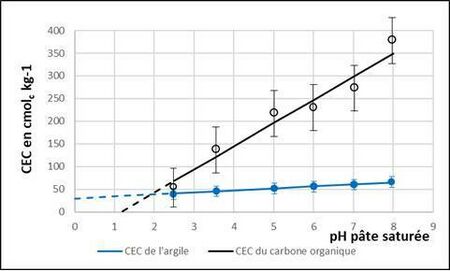
En 1948, une autre propriété de la CEC est montrée par Hosking : elle varie dans le même sens que le pH (Ruellan & Delétang, 1967, p 20). Hosking parle sans doute le premier de « Capacité d’échange de cations » au lieu de « Capacité d’échange de bases » et propose de mesurer la CEC au pH du sol et au pH 9, et de déterminer ainsi la variation de la CEC en fonction du pH ( Ruellan & Delétang, 1967, p 27). En 1949, Schofield étudie la variation de la charge nette de l’argile d’un sol avec des solutions de NH4Cl de différents pH. Il établit l’existence d’une charge négative permanente liée aux substitutions isomorphiques de l’argile, et d’une charge variable liée aux bordures des feuillets. En 1964, Helling et al. montrent d’une façon très claire, comme l’avaient noté les agronomes (Johnson, 1859 ; Demolon, 1932) que la MO adsorbe plus de cations que l’argile (figure 2). Il montre aussi que, lorsque le pH augmente, l’augmentation de la CEC de la MO est beaucoup plus forte que celle de l’argile, mais avec une variabilité plus élevée (figure 2).
Il est ainsi établi assez tôt que la CEC est constituée de deux types de charges négatives : les charges permanentes, situées sur les argiles, et les charges variables, dépendantes du pH, situées sur l’argile et sur la MO. Demolon (1952 : 287 ss) explique bien que les charges négatives de l’argile et de la MO sont à la base de l’échange de cations. Cependant, en France, pendant la deuxième moitié du XXe siècle, les découvertes précédentes ne touchent que de trop rares chercheurs. Les agronomes, comme les pédologues, considèrent la CEC comme constante, idée renforcée par sa mesure avec la méthode Metson à pH = 7. À l’occasion d’un colloque sur la capacité d’échange cationique réunissant près de 150 agronomes et pédologues (Amiet, 1987), Bourrié et Aurousseau rappellent pourtant que « l’acidification des sols se manifeste par une baisse du pH et … par une baisse des charges variables qui se traduit sur le plan analytique par une diminution de la Capacité d’Échange Cationique effective du sol (T) » (1987 : 159). Lors de ce colloque, il n’est pas fait état de la méthode mise au point pourtant dix ans auparavant par Orsini et Rémy pour déterminer justement la CEC effective du sol (1976). Cette méthode a été utilisée à partir de 1977 pour la carte des sols de l’Aisne au 1/25 000e. Mais, en 25 ans, elle a été très peu utilisée en France (Henry, 1997 ; Ciesielski et al., 1997).
Chaulage, pouvoir tampon du sol et CEC
Pour calculer une dose de chaulage, il faut estimer le pouvoir tampon du sol vis-à-vis du pH, cette propriété du sol de limiter plus ou moins la variation du pH pour un même apport de H+ (voir pH du sol, §5). Les agronomes français ont utilisé la CEC sans le savoir pour estimer le pouvoir tampon du sol. Demolon avait déterminé que « l’argile exige pour sa neutralisation théorique environ 1,1% de CaO. Pour la MO…, on peut admettre un chiffre voisin de 5,5% » (1932 : 201). Il précise que « un sol peut être considéré dans un état de saturation satisfaisant quand on a : Ca échangeable > 0,9 (1,1 Argile + 5 MO) » (id. : 225). Cette formule est en fait une estimation de la CEC à pH 7 et permet ensuite de calculer le pouvoir tampon du sol. La formule est utilisée d’abord par Joret et al. qui la combinent avec le taux de saturation d’Hissink (Joret et al., 1934). En 1969, pour le calcul de la dose de chaux, Rémy utilise la formule (Argile + 5 MO) dans le premier logiciel français d’interprétation automatique d’analyses de terre Laona (Rémy, 1970) puis dans Céres (Rémy & Marin-Laflèche, 1974). Cette formule sera reprise dans de nombreux logiciels d’interprétation d’analyses de terre. On notera que, dans l’article de Helling et al. (1964), le rapport moyen entre les contributions aux charges variables de l’argile et de la MO est de 1 à 6,7, proche de celui de Demolon (1,1 à 5) ou de Rémy et Marin-Laflèche (1 à 5).
Puis le taux de saturation de la CEC Metson va être très utilisé par les agronomes à la suite de sa vulgarisation par Julien (1987). Cela induit une représentation fausse du réservoir en cations du sol : un réservoir de taille constante plus ou moins rempli par des cations « basiques ». Le pouvoir tampon est alors estimé par le déficit de saturation, l’écart entre la somme des cations échangeables et la CEC à pH = 7 divisé par (7 – pH du sol). Pour les sols acides, le déficit de saturation est alors considéré comme assuré par des H+ échangeables et des Al3+ (Espiau, 1994 : 489 et 500).
Quelques précisions sur la CEC
Les charges négatives de la CEC sont donc de deux types : celles permanentes, indépendantes du pH, situées sur les surfaces basales des phyllosilicates (les substitutions isomorphiques, voir argile) et celles des sites à charge variable, dépendantes du pH, situées sur les matières organiques, les bordures des feuillets des phyllosilicates (l’argile vraie) et les oxydes et hydroxydes de fer et d’aluminium.
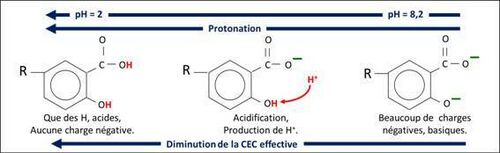
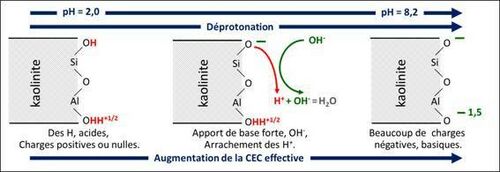
Lorsque les charges variables sont négatives, elles sont alors basiques, acceptant des ions H+ ; lorsqu’elles sont positives ou neutres, elles sont alors acides, donnant des ions H+ (figures 3 et 4). La relation entre l’état des charges variables et le pH est donc très étroite : selon l’objet étudié, on dira « les charges variables dépendent du pH » comme Espiau (1994 : 493) ou « le pH est contrôlé par les charges variables » comme dans l’article pH du sol.
Mécanisme de la protonation / déprotonation
Pour illustrer le mécanisme de variation des charges, la figure 3 schématise la protonation d’une molécule organique lors d’une acidification : l’ion H+ protone le site basique O-. La figure 4 schématise le mécanisme inverse pour une particule d’argile : lors d’un apport d’amendement basique, l’ion OH- arrache l’ion H+ du site acide OH ; on dit qu’il déprotone le site.
Dans les figures 3 et 4, les H font partie des surfaces (Sposito 1984 : 39 ; Sposito, 1989 : 135) où ils sont le plus souvent liés à un atome d’oxygène, parfois d’azote ou de soufre. Ces sites acides peuvent réagir avec les bases ajoutées OH- ou CO32-. C’est la raison pour laquelle les produits amendants qui augmentent le pH du sol sont appelés aujourd’hui des amendements basiques, et ce grâce au Groupe chaulage du Comifer (voir cations échangeables du sol).
Way (1850 : 358-359, expériences 82 et 83) avait noté, par exemple, que l’adsorption est plus importante avec KOH que KNO3, d’où l’une de ses règles : les hydroxydes et carbonates de Na+, K+ ou NH4+, par exemple NaOH, sont complètement adsorbés par le sol, sans déplacement de Ca2+. Demolon (1932 : 219), reprenant des essais de Charriou (1924) sur de l’acide humique de synthèse, note que : « la fixation décroît comme suit : KOH > CO3K2 > CO3KH > KCl ». La série suit la force des bases conjuguées : OH- > CO32-- > HCO3- > Cl-. Plus la base est forte, plus elle déprotone de sites acides, plus elle crée de sites négatifs, et plus de K+ sont adsorbés sur ces sites. Dans les sols, c’est le même mécanisme : avec un apport de KOH, la base OH- crée des sites négatifs sur lesquels s’adsorbe K+, sans échange. Une autre règle de Way, « le traitement par un acide tend à détruire l’adsorption », s’explique par le phénomène inverse : un apport d’acide entraîne la protonation des sites négatifs basiques ; il n’y a donc plus de possibilité d’adsorption pour les cations.
Estimation de la CEC effective
De nombreux travaux montrent, comme ceux de Helling et al. (1964), que le nombre de charges variables évolue d’une façon linéaire pour des pH du sol de 4 à 8 (McBride, 1994 : 99 ; Ciesielski et al., 2008 : 168). En utilisant le concept de « point de charge nulle » introduit par Sposito (1981), une relation linéaire entre la CEC effective, le pH du sol et les teneurs en argile granulométrique et en matière organique peut être établie (Bortoluzzi et al., 2006 ; Julien & Tessier, 2021) :
La CEC effective est exprimée en centimole de charge (cmolc) par kg, l’argile et le carbone organique Corg sont exprimés en g par kg, « a » est la densité de charge permanente des argiles en cmolc par g, « b » et « d » sont les densités de charge variable de l’argile et de Corg en cmolc par g par unité pHeau, « c » et « e » sont les pHeau des points de charge nulle de l’argile et du Corg (valeur du pHeau pour laquelle la somme de leurs charges est nulle).
Capacité à neutraliser les acides et pouvoir tampon
Dans le sol, les sites capables de neutraliser les acides sont les sites basiques des constituants solides du sol. Il s’en déduit une formulation simple de la capacité du sol à neutraliser les acides, ANC (Acid Neutralizing Capacity, van Breemen et al., 1983) : l’ANC est la somme des charges négatives des constituants du sol compensés par les cations échangeables Ca2+, Mg2+, K+ et Na+ (Sposito, 1989 : 214). Les charges négatives basiques compensées par Al3+ sont neutres du point de vue de l’ANC. Plus l’ANC est grande, plus le pouvoir tampon du sol est élevé. Ainsi, pour le calcul d’une dose de chaulage, ce sont les charges variables qui sont principalement à l’origine du pouvoir tampon des sols pour des pH du sol de 5 à 7,5. Le pouvoir tampon du sol, équation 2, peut être estimé à partir des teneurs en argile et carbone organique (en remplaçant la CEC par les termes de l’équation 1) :
Par rapport à la contribution « b » de l’argile aux charges variables, la contribution « d » de la MO est de 5 à 10 fois plus élevée dans les trois régressions publiées (Julien & Tessier, 2021), un ordre de grandeur analogue à ceux indiqués par Demolon (1932) ou Helling et al. (1964).
Rappelons que de nombreux processus influencent le pH du sol, en premier lieu la respiration, la pompe à protons racinaire et l’ammonification ou la nitrification (voir pH du sol). Il est possible de les prendre en compte dans les bilans de protons (Bourrié & Lelong, 1994).
Quelques conséquences agronomiques
L’agronome utilise beaucoup la CEC Metson car elle permet de calculer le pouvoir tampon et les doses de chaux en utilisant la notion de taux de saturation (voir cations échangeables). Comme cela n’est pas possible avec la seule CEC effective sans avoir les teneurs en argile et MO (voir ci-dessus), il faut changer le mode d’interprétation pour éviter d’avoir recours à cette notion fausse de taux de saturation (la CEC est toujours saturée). Pour les sols pas trop acides, avec un pH supérieur à 5,5 environ, la somme des cations échangeables Metson est une bonne estimation de la CEC effective. Les cations étant exprimés en g/kg, il est d’ailleurs plus facile de calculer la CEC effective en multipliant la CEC Metson par le « taux de saturation ». La taille de la CEC effective peut donc être interprétée à partir de la mesure Metson. Disposant ainsi à la fois d’une estimation de la CEC au pH du sol et d’une mesure de la CEC à pH = 7, l’agronome peut estimer le pouvoir tampon du sol à partir de l’équation 2, sans avoir recours au taux de saturation.
En revanche, pour les sols alcalins, il faut nécessairement déterminer la CEC effective avec la méthode d’Orsini et Rémy (1976). D’autre part, pour ces sols, la solution d’extraction utilisée dans la méthode Metson dissout des particules calcaires : les teneurs en Ca2+ sont alors surestimées.
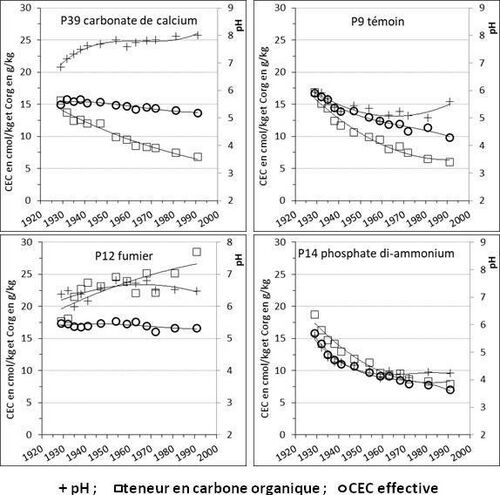
Enfin, la MO est classiquement considérée comme un facteur important de la structure du sol (Johannès et al., 2017). Ce facteur joue d’autant plus que la CEC effective de la MO est grande, donc que le pH est élevé. L’effet du pH et de la teneur en MO sur la CEC effective est illustré dans la figure 5.
En guise de conclusion
En guise de conclusion de ces trois articles, les observations de générations d’agronomes, Olivier de Serres, Duhamel du Monceau, Boussingault, Grandeau, Hall, Garola, Demolon, Kockmann et Fabre, mais aussi Bresson et Boiffin (1990), sont ainsi expliquées par le pH du sol, la CEC effective et les cations comme Ca2+. Pour les agronomes, la teneur en MO et le pH sont les principaux indicateurs analytiques permettant d’augmenter la CEC effective et susceptibles ainsi d’optimiser le fonctionnement du sol, tant du point de vue des cycles biogéochimiques que des propriétés physiques et mécaniques.
Références citées
- Amiet Y., 1987. Capacité d’échange cationique et fertilisation des sols agricoles. AFES, Caen, 280 p.
- Bortoluzzi E.C., Tessier D., Reinheimer D.S., Julien J.L., 2006. The cation exchange capacity of a sandy soil in southern Brazil: an estimation of permanent and pH-dependent charges. Eur. J. Soil Sci., 57 : 356-364.
- Bourrié G., Aurousseau P., 1987. pH et besoin en chaux. In : Y. Amiet, Capacité d’échange cationique et fertilisation des sols agricoles. AFES, Caen : 165-173.
- Bourrié G., Lelong F., 1994. Les solutions du sol : du profil au bassin versant. In : Bonneau et Souchier eds, Constituants et propriétés du sol. Masson, Paris : 239-273.
- Bourrié G., Julien J.L., 2022. pH eau, besoin en chaux des sols et acidité de surface. Étude et gestion des sols. À paraître.
- Bresson L.M., Boiffin J., 1990. Morphological characterization of soil crust development stage on a experimental field. Geoderma, 3-4, 301-325.
- Chapman D.L., 1913. A contribution to the theory of electrocapillarity. The London, Edinburgh, and Dublin Philosophical Mag. and J. of Sci., s. 625 (148): 475-481. Texte intégral.
- Christensen et Jensen, 1927. C.R. IIe Comm. Ass. Intern. Sc. du Sol, Groningen, 94-117.
- Ciesielski H., Sterckeman T., Santerne M., Willery J.P., 1997. A comparison between three methods for the determination of cation exchange capacity and exchangeable cations in soils. Agronomie, 17 (1) : 9-16.
- Ciesielski H., Sterckman T., Baliteau J.Y., Caria G., Goutiers V., Willery J.P., 2008. Evolution du pH et de la CEC de sols du Nord de la France en fonction des doses de chaulage (CaCO3). Influence du carbone organique. Étude et Gestion des Sols, 15 (3) : 161-170. Texte intégral.
- Coulomb C.A., 1785. Premier mémoire sur l’électricité et le magnétisme. Mémoires de l’Académie Royale des Sciences, 569-577. Texte intégral
- Demolon A., 1911. La pénétration des engrais dans le sol. Ann. Sci. Agron. Fr. Etr., Série 3, t. II.
- Demolon A., 1926. Recherches physico-chimiques sur la terre à brique envisagée comme milieu naturel (vol 1). Phénomènes d’adsorption dans les colloïdes (vol 2). Thèse de doctorat. Librairie scientifique Albert Blanchard, 94p.
- Demolon A., 1932. La Dynamique du sol. Dunod, Paris. 347p.
- Demolon A., 1952. La Dynamique du sol. 5e éd., Dunod, Paris. 520 p.
- Dufey J., 2001. Solution du sol, complexe d’échange et garniture ionique, évolution suite à l’acidification et au chaulage. In : D. Tessier, ed., L’acidification des sols : origine, approche, enjeux et maîtrise, INRA, Versailles, .
- Espiau P., 1994. Le complexe absorbant. In : Bonneau & Souchier eds, Constituants et propriétés du sol. Masson, Paris : 489-510.
- Garola C.V., 1903. Engrais. Baillière, Paris, xi + 502 p., fig. . Texte intégral
- Gouy G.L., 1910. Sur la constitution de la charge électrique à la surface d'un électrolyte. J. Phys. Théor. Appl., 9 (1) : 457-468.
- Hall, A. D., 1906. Le sol en agriculture. Traduit par A. Demolon. Baillère et fils, Paris. 432p.
- Helling C.S., Chesters G., Corey R.B., 1964. Contribution of organic matter and clay to soil cation exchange capacity as affected by the pH of the saturating solutions. Soil Sci. Soc. Am. Proc., 28 (4): 517-520.
- Helmholtz H., 1879. Studien über elektrische Grenzschichten. Annalen der Physik und Chemie, vol. 7: 337-340. Texte intégral.
- Hendricks S.B., Fry W.H., 1930. The results of X-ray and mineralogical examination of soil colloids. Soil Sci., 29: 457-476.
- Hénin S., 1938. Étude physicochimique de la stabilité structurale des terres. Thèse Univ. Paris, Imprimerie Nationale, Paris, 72 p. Texte intégral.
- Henry P., 1997. Relationship between porosity, electrical conductivity, and cation exchange capacity in Barbados wedge sediments. In: Shipley, Ogawa, Blum, Bahr, eds, Proc., Ocean Drilling Program, Scientific Results, Vol. 156, College Station, TX (Ocean Drilling Program): 137-148.
- Hissink D.J., 1925. Bases exchange in soils. Trans. of the Faraday Society, 20: 551-566. Texte intégral
- Hosking J.S., 1948. The cation exchange capacity of soils and soils colloids. 1. Variation with Hydrogen Ion concentration. J.C.S.I.R. (Australie) 21: 21-50.
- Johannes A., Weisskopf P., Schulin R., Boivin P., 2017. To what extent do physical measurements match with visual evaluation of soil structure? Soil and Tillage Research, 173: 24-32.
- Johnson S.W., 1859. On some points of agricultural science. Am. J. Sci. Arts. Ser. 2, 28: 71-85. Texte intégral.
- Joret G., Malterre H., Cazaban M., 1934. L’appréciation des besoins en chaux des sols de limons d’après leur état de saturation en bases échangeables. Ann. Agron., 22, 4 : 453-479.
- Julien J.L., 1987. CEC et analyse de terre. Mise au point de normes d’interprétation. I, l’exemple de l’état calcique. In : Y. Amiet ed, Capacité d’échange cationique et fertilisation des sols agricoles. AFES, Caen, 174-177.
- Julien J.L., 2017. Entre agronomie et agriculture, la Station agronomique de l’Aisne. L’Harmattan, Paris, 315p.
- Julien J.-L., Tessier D., 2021. Rôles du pH, de la CEC effective et des cations échangeables sur la stabilité structurale et l’affinité pour l’eau du sol. Étude et Gestion des Sols, 28 : 159-179. Texte intégral
- Kelley W.P., Dore W.H., Brown S.M., 1931. The nature of the base exchange material of bentonite, soils and zeolites, as revealed by chemical investigation and X-ray analysis. Soil Sci., 31, 25-55.
- Lewis G.N., 1916. The Atom and the Molecule, J. Am. Chem. Soc., vol. 38, n° 4: 762–785.
- McBride M.B., 1994. Environmental chemistry of soils. Oxford University Press, 406 p.
- Mc George, 1931. The base exchange properties of soil organic matter. J. Am. Soc. Agron., 23 (5): 331.
- Metson A.J., 1956. Methods of chemical analysis for soil survey samples. N.Z. Soil Bur. Bull., n°12.
- Orsini L., Rémy J.C., 1976. Utilisation du chlorure de cobaltihexammine pour la détermination simultanée de la capacité d’échange et des bases échangeables des sols. Science du sol, 4 : 269-275.
- Petit A., 2013. Histoire du concept d’ions au dix-neuvième siècle. Thèse de doctorat, Univ. Nantes. 367p.
- Rémy J.C., 1970. L’analyse agronomique des sols. Programmation sur ordinateur. 23 p. Cité par Julien, 2017 : 113.
- Rémy J.C., Marin-Laflèche A., 1974. L’analyse de terre : réalisation d’un programme d’interprétation automatique. Ann. Agron., 25 (4) : 607-632.
- Ruellan A., Delétang J., 1967. Les phénomènes d’échange de cations et d’anions dans les sols. Initiations - documentations techniques, n°5. Orstom Paris, 123 p. Texte intégral.
- Russell E.W., 1934. The interaction of clay with water and organic liquids as measured by specific volume changes and its relation to their phenomena of crumb formation in soils. Phil. Transact. R. Soc. London, 233 A : 361-389.
- Saby N.P.A., Lemercier B., Arrouays D., Leménager S., Louis B.P., Millet F., Paroissien J.-B., Schellenberger E., Squividant H., Swiderski C., Toutain B., Walter C., Bardy M., 2014. Le programme Base de Données des Analyses de Terre (BDAT) : Bilan de 20 ans de collecte de résultats d’analyses. Étude et Gestion des Sols, vol. 21 : 141-150. Texte intégral.
- Schloesing J.J.T., 1874. Étude sur la terre végétale. Ann. Chim. Phys., 5e série, t. 2 : 514-546. Texte intégral.
- Schofield R.K., 1949. Effect of pH on electric charges carried by clay particles. Soil Sci., I, l: 1-8.
- Sposito G., 1981. The operational determination of zero point of charge in soils. Soil Sci. Soc. Am. J., 45 : 292-297.
- Sposito G., 1984. The Surface Chemistry of Soils. Oxford University Press, New-York, 284p.
- Sposito G., 1989. The Chemistry of Soils. Oxford University Press, New-York, 277p.
- Sterckeman T., Caria G., 2022. Évolution du pH et de la CEC de sols du Nord de la France en fonction des doses de chaulage (CaCO3) – Influence du carbone organique. Réponse à un commentaire. Étude et Gestion des Sols, 29 : 73-76. Texte intégral.
- Stern O., 1924. Zur Theorie der Elektrolytischen Doppelschicht. Zeitschrift für Elektrochemie, 30: 508-516.
- Thomas, G.W., 1977. Historical developments in soil chemistry. Soil Sci. Soc. Am. J., 41: 230-237.
- Van Breemen N., Driscoll C.T., Mulder J., 1983. Acidification and alkalinization of soils. Plant and Soil, 75 (3): 283-308.
- van Oort F., Paradelo R., Baize D., Chenu C., Delarue G., Guérin A., Proix N., 2022. Can long-term fertilization accelerate pedogenesis? Depicting soil processes boosted by continuous annual NPK-inputs on a bare loess Luvisol since 1928 (INRAE-Versailles, France). Geoderma : 416.
- Way J. Th., 1850. On the power of Soil to absorbe Manure. J. Royal Agric. Soc. Engl., 11 : 313-379. Texte intégral