Cations échangeables du sol
Auteurs : Jean-Luc Julien, Guilhem Bourrié, Ary Bruand, Christian Feller, Daniel Tessier et Folkert van Oort
| Le point de vue de... | |
|---|---|
Pas de compléments pour cet article
| |
| Annexes de l'article | |
Pas d'annexes pour cet article
| |
| Voir aussi (articles complémentaires) | |
| Autres langues | |
| Informations complémentaires | |
Article accepté le 15 juin 2022
| |
| Article mis en ligne le 15 juin 2022 |
Définition
Dans le sol, la plupart des ions chargés positivement, les cations, sont adsorbés sur des constituants chargés négativement : la matière organique (MO) et les minéraux argileux (les phyllosilicates) (voir Capacité d'échange cationique du sol). Les autres sont dans la solution du sol, en équilibre avec ceux adsorbés. L’échange est continuel entre ces deux compartiments : les cations sont dits échangeables. Dans cet article, l’expression cations échangeables se réfère à quatre d’entre eux : le calcium, Ca2+, le magnésium, Mg2+, le potassium, K+, et le sodium, Na+. Pour les doser, on utilise cette propriété d’échange en remplaçant les cations du sol par un autre cation.
Le dosage des cations échangeables est très utilisé par les agronomes pour caractériser un sol, avec la texture, la teneur en matière organique, le pH du sol et la capacité d’échange cationique (CEC). Les teneurs en ces quatre cations sont déterminées dans 95% des analyses de terre demandées par les agriculteurs et interprétées par les agronomes (Saby et al., 2014).
D’autres cations échangeables existent, comme les ions de l’aluminium ou l’ion ammonium NH4+.
Histoire des connaissances sur les échanges de cations
La représentation qu’ont les agronomes de l’acidité du sol et leur compréhension des processus qui y sont associés ont profondément évolué en 300 ans. Le pH du sol, les cations échangeables et la capacité d’échange illustrent cette évolution et sont historiquement liés : il est donc utile de lire ces trois articles, si possible dans cet ordre. L’histoire est abordée essentiellement du point de vue des agronomes français. Les relations avec la nutrition des plantes ne sont pas traitées.
Mise en évidence
La découverte des principaux éléments chimiques s’est faite pendant le XVIIIe siècle et Lavoisier et al. en établissent la nomenclature en 1787. Dalton élabore une théorie des atomes en 1808, mais cette théorie mettra plus d’un siècle à être formalisée. Faraday introduit la notion d’ion en 1834. L’histoire des cations échangeables commence avec Liebig qui développe en 1840 (1862) la théorie de la nutrition minérale des plantes. En 1847, H.S. Thompson, un agriculteur du Yorkshire, fait les premières mesures quantitatives sur l’échange d’ions, publiées en 1850. Il parle de ses résultats à Way, jeune consultant chimiste de la Royal Agriculture Society. Way (1850) fait près d’une centaine de mesures en laboratoire sur des cylindres remplis de différents sols en y ajoutant des solutions de presque tous les ions rencontrés dans les sols. Il observe que les anions ne sont pas retenus par le sol. Pour les cations, il note un cas où il y a échange, un autre ou il y a seulement adsorption, sans échange. Deux des neuf règles de Way sont corrigées très tôt par Johnson (1859) qui a refait ses expériences : l’échange est réversible et, outre l’argile, la matière organique participe également à l’échange de cations. Johnson est à l’origine de l’expression échange de bases (Thomas, 1977).
Ainsi commence l’ère de la chimie agricole. L’évolution des connaissances sur l’échangeur sol est décrite dans l’article capacité d’échange cationique.
Les cations : des bases ou des acides ?
Au XIXe siècle, accord entre les chimistes et les agronomes
Au XIXe siècle, les notions d’acide et de base sont connues, mais pas encore formellement définies (voir pH du sol). En 1800, Volta invente la pile qui porte son nom. Ce premier générateur électrique connut un succès foudroyant et ses successeurs, plus stables et efficaces, furent très utilisés par les chimistes (Petit, 2013 : 19-20). Cet engouement pour l’« électrochimie » conduit en 1802 Napoléon à souhaiter récompenser d’une médaille et d’un prix de 60 000F « la meilleure expérience qui sera faite dans le cours de chaque année sur le fluide galvanique » (Petit, 2013 : 60). Il faudra cependant plus d’un siècle pour définir l’électricité, les ions, les acides et les bases. En 1811, Berzelius introduit le concept d’électropositivité, propriété d’un corps chimique à aller vers le pôle négatif, et de façon symétrique celui d’électronégativité. Estimant inadaptée la terminologie utilisée, Faraday « se propose désormais d'employer certains autres termes » (Faraday, 1834 : 77). Il remplace le mot pôle par électrode et invente le terme électrolyte pour qualifier le corps décomposé par le passage du courant. Puis, avec l’aide du Révérend Whewell, connu pour sa rigueur sémantique, il crée les termes d’anode, cathode, ion, anion et cation (Faraday, 1834 ; Petit, 2013 : 92-95).
Way n’utilise pas le mot ion, mais, lorsque, par exemple, il ajoute dans sa colonne de terre du sulfate d’ammonium, il observe à la base de la colonne du sulfate de chaux. Il en déduit que « le sel n’est pas absorbé en entier, mais seulement la base ». Pour lui, l’ammonium (NH4+) qui a été absorbé est une base. Et dans son mémoire, tous les cations sont pris pour des bases. Alfred Riche, professeur de chimie à l’École supérieure de pharmacie de Paris, illustre bien la vision qu’ont les chimistes des acides et des bases. Dans sa présentation des corps chimiques, il aborde l’aspect électrique : « en dirigeant un courant électrique à travers une dissolution de sulfate de soude… colorée en violet par l’infusion de chou rouge… on voit la teinte devenir rouge au pôle positif, ce qui montre qu’un acide s’y est porté, et cette teinte verdir au pôle négatif, ce qui indique en ce point la présence d’une base. Donc, dans un sel, l’élément électronégatif est l’acide » (Riche, 1876 : 13-15). L’interprétation paraît logique, au pôle négatif, il y a bien accumulation de Na+ mais aussi d’OH-, on ne le comprendra que plus tard, et c’est la base OH- qui fait verdir l’infusion[1]. Pour les chimistes de l’époque, la seule propriété spécifique des ions est de se mouvoir sous l’effet d’un courant électrique.
Les agronomes du XIXe siècle parlent eux aussi des bases. Pour Grandeau, commentant la théorie minérale de Liebig, « il est certain que les bases alcalines (potasse, soude, chaux, magnésie) doivent … être nécessaires à la végétation » (1879 : 66). Garola explique que « les propriétés absorbantes du sol pour les bases des sels fertilisants des engrais sont bien l’apanage de l’argile et de l’humus » (1903 : 28). Hall n’utilise le terme de « base » qu’exceptionnellement. Rappelant les expériences de Way, il écrit : « quand on maintient en contact avec de la terre une solution de sulfate, de chlorure ou de nitrate d’ammoniaque, la base est absorbée, mais l’acide du sel reste dans la solution à l’état de combinaison avec la chaux » (1906 : 309). Les agronomes et les chimistes sont donc d’accord sur le fait que ces molécules, qu’ils n’appellent pas encore cations, sont des « bases ».
Au XXe siècle, les chimistes et les agronomes ne sont plus d’accord
En 1889, Nernst émet l’idée que les ions sont chargés électriquement. Il les note avec les signes « + » et « – » en exposant : NH4+ ou Cl-. J.J. Thompson découvre en 1897 l’existence des électrons. En 1911, Rutherford propose une structure de l’atome originale : un noyau très petit chargé positivement et un nuage d’électrons chargés négativement compensant la charge du noyau. Ce modèle continue d’évoluer de nos jours. Pour les chimistes, les ions sont dès lors expliqués : un anion a gagné un (ou plusieurs) électron(s), un cation en a perdu. En 1923, Brønsted et Lowry définissent les bases et les acides : « un acide donne un ion H+, une base l’accepte » (voir pH du sol).
Les acides, les bases et les ions étant définis, la représentation des cations par les agronomes aurait dû évoluer : un cation comme Ca2+ ne peut pas être une base, c’est-à-dire accepter un H+. Demolon, dans tout son ouvrage de 1932, parle bien des ions et, comme Nernst, les note Ca2+ ou K+. Mais il emploie rarement le mot cation, préférant le mot « base ». L’expression base échangeable devient la règle chez les agronomes. Pour eux, le seul cation acide est H+, considéré lui aussi comme échangeable, quoique « toutefois plus énergiquement fixé et par conséquent plus difficile à remplacer » (Demolon, 1932 : 188). Il est établi assez tôt que l’affinité des cations pour les sites négatifs augmente avec leur charge et, pour des cations de même charge, suit les deux séries ci-dessous (Gieseking & Jenny, 1936) :
Dans l’entre-deux guerres, l’ion aluminium est mis en évidence (Ségalen, 1973 : 84). Et jusqu’à la fin du XXe siècle, deux grands types de cations échangeables se retrouvent dans quasiment toutes les publications scientifiques et les ouvrages de vulgarisation sur le sol (Espiau, 1994 : 500) :
- a) Les cations échangeables « basiques », appelés communément « bases échangeables », Ca2+, Mg2+, K+ et Na+. Ces cations « alcalins » sont censés neutraliser les H+ pour les pH compris entre 5 et 6,2 (Bruckert & Rouiller, 1994 : 514 ; Soltner, 2000 : 88).
- b) Les cations échangeables acides Al3+ et H+, appelés « acidité d’échange », présents uniquement dans les sols acides (certains ions de l’aluminium sont amphotères, pouvant donner ou accepter des protons).
Les dégâts dus au concept de « taux de saturation »
Hissink invente en 1925 le concept de taux de saturation. Il se fonde sur le mécanisme de l’échange d’ions établi par Way (1850), en prenant pour exemple l’équilibre suivant, notant les ions comme Nernst :
Il explique que, si l’équilibre se déplace vers la droite, le sol devient ainsi « less insaturated » et moins acide. Comme Demolon, il ne parle pas de cation mais de « base échangeable ». Il définit « S », la somme des cations échangeables (Ca2+ + Mg2+ + K+ + Na+), « T » la somme des cations échangeables potentiellement adsorbés, et « V » le taux de saturation actuel, avec V = S/T en %. Il note une relation entre le taux de saturation « V » et le pH du sol. Ce concept de taux de saturation va être adopté dans le monde entier, avec des méthodes variées de mesure de « T ».
En accord avec Hissink, Demolon explique ainsi que « l’acidification est liée à la désaturation du complexe absorbant. L’action du chaulage réside dans le remplacement par Ca d’ions H de ce complexe » (1932 : 227). Tout est clair et cohérent : les cations « basiques » chassent les H+ acides du complexe argilo-humique, et le pH augmente. En France, la première application est due à Joret qui, pour estimer « T », reprend la formule [Argile + (5 x MO)] de Demolon (Joret et al., 1934 ; voir Capacité d'échange cationique du sol §3). Julien (1987) vulgarise la mesure de « T » avec la CEC à pH 7 de Metson (1956) en expliquant : « en apportant du calcium… on augmente le taux de saturation et donc le pH ; inversement, toute perte de calcium entraîne une baisse… du pH ».
Le concept de taux de saturation renforce ainsi la représentation que les agronomes et les pédologues ont des cations « basiques » Ca2+, Mg2+, K+ et Na+. Pour les agronomes, les conséquences sont limitées. Pour les chercheurs en Science du sol, les effets réels de l’acidification sur le sol et ses propriétés seront mal compris (voir Capacité d'échange cationique du sol).
La correction du terme « base » échangeable
En 1995, deux agronomes de terrain, soucieux de valoriser les résultats de leurs essais sur le chaulage (Kockmann & Fabre, 1989 ; voir pH du sol), relancent le Groupe Chaulage du Comité Français d'Étude et de Développement de la Fertilisation Raisonnée (Comifer). Lors de la première réunion, Turpin, professeur de chimie à l’École Nationale de Formation Agronomique, reprend la définition de Brønsted et Lowry, « un acide donne un ion H+, une base l’accepte » et explique que les cations comme Ca2+ ne peuvent pas être des bases. Et que, dans un amendement comme la chaux vive ou le calcaire, l’élément basique est OH- ou CO32-. Il faudra plusieurs années au Groupe Chaulage pour comprendre toutes les conséquences de cette définition très simple (voir Capacité d'échange cationique du sol). La plupart des chercheurs contactés par le Groupe chaulage sont sceptiques, et pas seulement en France. À titre d’exemple, aux USA en 1987, un professeur d’écologie forestière, Binkley, reproche à Brady, auteur d’un des ouvrages les plus lus de Science du sol aux USA (Brady, 1984), d’utiliser le terme de cation « basique ». L’éditeur, Soil Science Society American Journal, publie en dernier, ce qui peut sembler une conclusion du débat, une défense des cations « basiques » par deux autres professeurs de sciences forestières (Binkley, 1987 ; Brady, 1987 ; Harrison & Johnson, 1987).
Un membre du Comifer, Maréchal, agronome de l’industrie des engrais, conseille au Groupe Chaulage de proposer une séance à l’Académie d’Agriculture de France. Cette séance, organisée par Tessier et Charlet, permettra d’établir définitivement que les cations ne sont pas des bases (Tessier et al., 1999). Tessier confortera cette clarification majeure en organisant un colloque sur l’acidification des sols (Tessier et al., 2001). La première conséquence fut la modification par Baize de son ouvrage sur les analyses de sol en pédologie (2002).
Gaumont, membre du Groupe Chaulage et agronome du fabricant d’amendements MEAC, mettra près de cinq ans pour modifier les normes française (NF U44-001, 1988 et 2001) et européenne (NF EN 12944-3, 2000 et 2002) concernant les amendements, remplaçant entre autres les termes amendements calciques et/ou magnésiens par amendements minéraux basiques.
Quelques précisions sur les cations
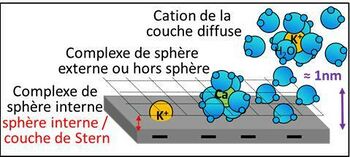
Les cations échangeables Ca2+, Mg2+, K+ et Na+ sont donc des acides, très faibles il est vrai. À proximité des charges négatives de l’argile et de la MO, les cations échangeables peuvent avoir trois grands types de position (Charlet & Schlegel, 1999) (figure 1) :
- a) Dans la couche de Stern, à une distance des charges négatives très faible, de l’ordre du dixième de nanomètre : les complexes de sphère interne (inner sphere). Les cations ne sont pas hydratés. C’est le cas en particulier du K+ dans les cavités siloxanes du réseau cristallographique des argiles.
- b) A une distance de l’ordre du nanomètre des charges négatives : les complexes de sphère externe (outer sphere). Les cations sont entourés de 4 à 8 molécules d’eau, la sphère d’hydratation. C’est la position standard des Ca2+ avec 6 molécules d’eau.
- c) A une distance des charges négatives supérieure au nanomètre : les cations de la couche diffuse. Ils peuvent être alors entourés de beaucoup de molécules d’eau, jusqu’à une centaine par cation (Julien & Tessier, 2021). C’est le cas classique de K+ et Na+.
Les vitesses d’échange entre les cations adsorbés et la solution du sol dépendent de leur position : complexe de sphère interne << complexe de sphère externe < ion de la couche diffuse. En raison de l’agitation thermique, l’échange d’ions entre ceux de la sphère externe, ceux de la couche diffuse et ceux de la solution du sol est continuel : c’est le mécanisme à la base de l’échange de cations. Les cations de la solution du sol sont également entourés de molécules d’eau.
Contrairement aux représentations courantes du complexe adsorbant (Soltner, 2000 : 86) et à certains écrits (Espiau, 1994 : 500), la concentration en ions H+ échangeables ne devient sensible que pour des pH du sol inférieurs à 4. Ces ions H+ échangeables sont soit dans la sphère externe, soit dans la couche diffuse (Sposito, 1989, p 135) (voir capacité d’échange cationique).
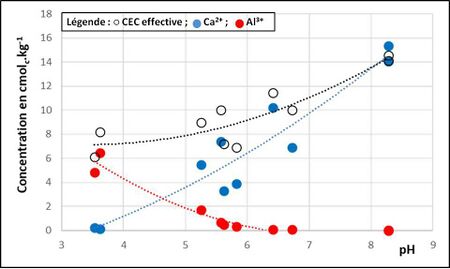
Dans les conditions de sols et climats où le drainage l'emporte sur l'évapotranspiration, la tendance géochimique générale est à l'acidification. Au fur et à mesure que le pH du sol baisse, la CEC et les concentrations en cations échangeables diminuent aussi. Vers un pH de 6 commencent à apparaître les cations de l’aluminium (figure 2).
Quelques conséquences agronomiques
Pour expliquer qu’un apport de gypse (CaSO4) ne permet pas d’augmenter le pH, les agronomes avaient « inventé » que l’ion sulfate (SO42-) « est un radical acidifiant qui contrebalance l’action de Ca2+ » (Coppenet et al., 1986 : 81). Il ne s’agit pas d’une simple erreur de vocabulaire, l’exemple suivant montre que c’est plus grave.
Les agronomes considéraient que les pertes de cations « basiques » par lessivage contribuaient à l’acidification du sol. En fait, ce sont les pertes des anions par lessivage qui sont préjudiciables : la perte d’un ion HCO3-, qui est basique, correspond bien à une acidification.
Mais quand il s’agit de NO3-, un anion de basicité négligeable, donc sans effet sur le pH ? Dans le sol, l’absorption de NO3- par les racines s’accompagne nécessairement d’absorption de H+ : il y a donc alcalinisation du sol. La perte de NO3- par lessivage correspond donc bien à une acidification du sol.
En conséquence, les cultures intermédiaires pièges à nitrates, les Cipan, sont aussi des pièges à protons (Fabre et al., 2009 : 14) ! Les Cipan ont ainsi un triple intérêt environnemental : limiter la pollution nitrique des nappes phréatiques et, vis-à-vis du changement climatique, diminuer de facto les apports d’azote et d’amendements basiques, tous deux gros émetteurs indirects de CO2. Certains agronomes (Ceschia, 2020 ; Ceschia et al., 2020) oublient ces effets, se concentrant trop sur l’effet stockage de carbone jugé par ailleurs limité (Berthelin et al., 2022).
« Ce que l’on conçoit bien s’énonce clairement, et les mots pour le dire arrivent aisément » (Boileau, 1674, l’Art poétique, chant I, vers 153-154). Quant à l’art scientifique, avec des mots justes, ceux de Faraday (1834) et de Brønsted (1923) et Lowry (1923), les agronomes peuvent avoir une conception correcte du fonctionnement de ce milieu complexe qu’est le sol. Et les pratiques qu’ils préconisent seront adaptées aux enjeux de l’agriculture d’aujourd’hui.
Notes
- ↑ En fait, il y a, à l’électrode négative, un dégagement d’hydrogène et une accumulation des ions Na+ et OH– constitutifs de la soude, correspondant à l’observation d’alcali du côté négatif ; à l’électrode positive, il y a un dégagement d’oxygène et une accumulation des ions H+ et SO42– constitutifs de l’acide sulfurique, correspondant à l’observation d’acide du côté positif (Bardez, 2012 : 25).
Références citées
- Baize D., 2002. Les analyses de sol en pédologie. Quae.
- Bardez E., 2012. L’acido-basicité. Bulletin de la Sabix N°50 Chimie et révolutions : 15-29.
- Berthelin J., Laba M., Lemaire G., Powlson D., Tessier D., Wander M., Baveye P.C., 2022. Soil carbon sequestration for climate change mitigation: Mineralization kinetics of organic inputs as an overlooked limitation. Eur. J. Soil Sci., 73.
- Berzelius J.J., 1811. Essai sur la nomenclature chimique. Journal de physique de chimie et d’histoire naturelle, 73 : 253-286. Texte intégral.
- Binkley D., 1987. Use of the Terms “Base cations” and “Base saturation” Should be Discouraged. SSSAJ, Comments and letters to the editor, 1089-1090.
- Boileau N., 1674. L’Art poétique, chant I. Texte intégral.
- Brady N.C., 1984. The nature and properties of soils. 9e ed., MacMillan, New-York & Londres, xvii + 750 p.
- Brady N.C., 1987. Reply to “Use of the Terms “Base cations” and “Base saturation” Should be Discouraged”. SSSAJ, Comments and letters to the editor, p 1090.
- Brønsted J.N., 1923. Some remarks on the concept of acids and bases. Recueil des Travaux Chimiques des Pays-Bas, 42 (8) : 718–728.
- Bruckert S., Rouiller J., 1994. Mécanismes de régulation du pH des sols. In : Bonneau et Souchier, eds, Constituants et propriétés du sol. Masson, Paris : 511-524.
- Ceschia E., 2020. Cultures intermédiaires et intercalaires. In : S. Pellerin et al., Stocker du carbone dans les sols français. Quel potentiel au regard de l’objectif 4 pour 1000 et à quel coût ? Rapport scientifique de l’étude réalisée pour l’ADEME et le Ministère de l’Agriculture et de l’Alimentation. INRA : 166-176. Texte intégral.
- Ceschia E., Delame N., Launay C., Schiavo M., 2020. Annexe I. Fiche de la pratique stockante "Insérer et allonger les cultures intermédiaires". In : S. Pellerin. et al., Stocker du carbone dans les sols français. Quel potentiel au regard de l’objectif 4 pour 1000 et à quel coût ? Rapport scientifique de l’étude réalisée pour l’ADEME et le Ministère de l’Agriculture et de l’Alimentation. INRA : 397-416. [1] Texte intégral.
- Charlet L., Schlegel M.L., 1999. La capacité d’échange des sols. Structures et Charges à l’interface eau-particules. C.R. Acad. Agric. Fr., 85 (2) : 7-24. Texte intégral
- Charriou A., 1924. Sur l’absorption de la potasse par l’acide humique. C.R. Séances Ac. Sc. Paris, 179 : 206-209. Texte intégral
- Coppenet M., Ailliot B., Cariou G., Colomb B., Darre J., Haut R., 1986. État calcique des sols et fertilité : le chaulage. Comifer. Acta Ed., 174p.
- Dalton J., 1808. A New System of Chemical Philosophy. Manchester, 600 p. Texte intégral
- Demolon A., 1932. La Dynamique du sol. Dunod, Paris, 347p.
- Espiau P., 1994. Le complexe absorbant. In : Bonneau et Souchier, eds, Constituants et propriétés du sol, Masson, Paris : 489-510.
- Fabre B., Felix-Faure B., Bouthier A., Castillon P., Cahurel J.Y., Damay N., Julien J.-L., Duval R., Fabre A., Kalt S., Gaumont F.X., Peltier O., Steinmann J.-F., Tessier C., Ponchon F., Thibierge J., Valé M., 2009. Le chaulage, des bases pour le raisonner, version 2, Comifer, Groupe Chaulage, 111 p.
- Faraday M., 1834. On Electro-chemical Decomposition, continued. Experimental researches in electricity, series 7, Philosophical Transactions of the Royal Society, 124: 77-122. Texte intégral
- Garola C.V., 1903. Engrais. Baillière, Paris, xi + 502 p., fig. Texte intégral.
- Gieseking J.E., Jenny H., 1936. Behavior of polyvalent cations in base exchange. Soil Sci., 42: 273-280.
- Grandeau L., 1879. Cours d’agriculture de l’École forestière. Chimie et physiologie appliquée à l'agriculture et à la sylviculture. 1. La nutrition de la plante. Berger-Levrault, Paris, 624 p. Texte intégral.
- Hall, A. D., 1906. Le sol en agriculture. Traduit par A. Demolon. Baillère, Paris, 432p.
- Harrison R.B., Johnson D.W., 1987. Comment on “Use of the Terms “Base cations” and “Base saturation” Should be Discouraged”. SSSAJ, Comments and letters to the editor, 1090-1091.
- Hissink D.J., 1925. Bases exchange in soils. Transactions of the Faraday Society, 20: 551-566.
- Johnson S.W., 1859. On some points of agricultural science. Am. J. Sci. Arts. Ser., 2, 28: 71-85.
- Joret G., Malterre H., Cazaban M., 1934. L’appréciation des besoins en chaux des sols de limons d’après leur état de saturation en bases échangeables. Ann. Agron., 22, 4 : 453-479.
- Julien J.L., 1987. CEC et analyse de terre. Mise au point de normes d’interprétation. I, l’exemple de l’état calcique. In : Y. Amiet, ed., CEC et fertilisation des sols agricoles, 174-177.
- Julien J.-L., Tessier D., 2021. Rôles du pH, de la CEC effective et des cations échangeables sur la stabilité structurale et l’affinité pour l’eau du sol. Étude et Gestion des Sols, 28 : 159-179. Texte intégral
- Kockmann F., Fabre B., 1989. Chaulage et modifications de la fertilité physique en sols limoneux hydromorphes. In : Dodd & Grace, eds, Agricultural Engineering, vol 3. Balkerna, Rotterdam : 1817-1823.
- Lavoisier, A. L., Guyton de Morveau L.B., Berthollet C.L., Fourcroy A.F. de, 1787. Méthode de nomenclature chimique. Paris. Texte intégral.
- Liebig J. (von), [1840], 1862. Les lois naturelles de l’agriculture. Traduit par Ad. Scheler, édition revue et corrigée par l’auteur, Paris, L'a Maison rustique, tome I, 184 p, t. II, 487 p. Texte intégral.
- Lowry T. M., 1923. The uniqueness of hydrogen. Journal of the Society of Chemical Industry, 42: 43-47.
- Metson A.J., 1956. Methods of chemical analysis for soil survey samples. N.Z. Soil Bur. Bull. n°12.
- Nernst W., 1889. Raisonnement de la chimie théorique : neuf articles (1889-1921) (Begründung der Theoretischen Chemie: Neun Abhandlungen, 1889-1921). Francfort-sur-le-Main.
- NF U44-001, 1988. Amendements calciques et/ou magnésiens. Dénominations et spécifications.
- NF U44-001, 2001. Amendements minéraux basiques. Dénominations et spécifications.
- NF EN 12944-3, 2000. Engrais et amendements calciques et/ou magnésiens. Vocabulaire.
- NF EN 12944-3, 2002. Engrais et amendements minéraux basiques. Vocabulaire.
- Petit A., 2013. Histoire du concept d’ions au dix-neuvième siècle. Thèse doctorat, Univ. Nantes. 367 p.
- Riche A., 1876. Leçons de chimie, 3e édition, t. 1. Firmin-Didot, Paris, 736 p. Texte intégral Texte intégral
- Rutherford E., 1911. The Scattering of α and β Particles by Matter and the Structure of the Atom. Philosophical Magazine 6, (21): 669-688. Texte intégral.
- Saby N.P.A., Lemercier B., Arrouays D., Leménager S., Louis B.P., Millet F., Paroissien J.-B., Schellenberger E., Squividant H., Swiderski C., Toutain B., Walter C., Bardy M., 2014. Le programme Base de Données des Analyses de Terre (BDAT) : Bilan de 20 ans de collecte de résultats d’analyses. Étude et Gestion des Sols, 21 : 141-150. Texte intégral
- Ségalen P., 1973. **L’aluminium dans les sols**. Initiations - Documentations techniques, n° 22. Orstom, Paris. 281 p. Texte intégral.
- Soltner D., 2000. **Les bases de la production végétale. T. 1. Le sol et son amélioration**. 22e édition. Collection Sciences et Techniques Agricoles, Ste Gemmes/Loire, 472 p.
- Sposito G., 1989. The Chemistry of Soils. Oxford University Press, New-York, 277p.
- Tessier D., Charlet L., Schlegel M.L., Julien J.L., Turpin A., 1999. La capacité d’échange des sols et son importance pour la gestion actuelle des sols. C.R. Acad. Agric. Fr., 85-2, 3-50. Texte intégral
- Tessier D. et al., 2001. L’acidification des sols : Origine, approche, enjeux et maîtrise. Colloque Afes Inra.
- Thomas, G.W., 1977. Historical developments in soil chemistry. Soil Sci. Soc. Am. J., 41 : 230-237.
- Thompson H.S., 1850. On the absorbent power of soils. J. Royal Agric. Soc. Engl., 11 : 68-74. Texte intégral.
- Thompson J.J., 1897. Cathode Rays. Philosophical Magazine and Journal of Science. Series 5, vol. 44, n° 269: 293-316. Texte intégral.
- van Oort F., Paradelo R., Baize D., Chenu C., Delarue G., Guérin A., Proix N., 2022. Can long-term fertilization accelerate pedogenesis? Depicting soil processes boosted by continuous annual NPK-inputs on a bare loess Luvisol since 1928 (INRAE-Versailles, France). Geoderma : 416.
- Way J. Th., 1850. On the power of Soil to absorbe Manure. J. Royal Agric. Soc. Engl., 11 : 313-379. Texte intégral.